“La nostra proposta per una nuova governance prevede una nuova strategia per il governo dell’innovazione dei dispositivi medici. – dichiara il ministro della Salute, Giulia Grillo– I dispositivi medici hanno acquisito un ruolo centrale nella pratica clinica migliorando sia la salute che la qualità della vita dei pazienti. L’industria dei dispositivi medici, che conta 4mila imprese e circa 67mila addetti, è infatti considerevolmente cresciuta negli ultimi anni, di pari passo con l’espansione della sfera assistenziale che ricopre.
Come già ribadito per la governance dei farmaci, il documento che presentiamo oggi al ministero, con le dottoresse Marcella Marletta, Luciana Ballini e Giovanna Scroccaro, evidenzia che la domanda di dispositivi medici, e in particolare per quelli in ingresso sul mercato considerati innovativi, dev’essere guidata dal criterio del valore clinico assistenziale aggiuntivo rispetto a quanto già disponibile” chiarisce.
“Il processo di valutazione può produrre diverse tipologie di raccomandazioni: non adozione, adozione o adozione solo in ricerca, tenendo quindi conto dei limiti del processo regolatorio e dando spazio alle potenzialità non pienamente dimostrate di un elevato valore aggiunto, attraverso l’impulso alla ricerca clinica” precisa Grillo.
“Sarà possibile realizzare gli obiettivi del documento grazie a quanto il nostro Paese ha fatto in questo settore negli ultimi anni e alla disponibilità nel nostro sistema di competenze professionali che non sono sicuramente seconde ad altre” conclude il ministro.
La proposta di governance vorrebbe affrontare le criticità derivate da:
- un settore in forte espansione, ad alta intensità di rinnovamento e crescente complessità tecnologica, non sempre facilmente riconducibile a un reale impatto in termini di migliori risultati di cura per i pazienti.
- Un regolamento Europeo che non vincola l’autorizzazione al mercato dei dispositivi medici alla presentazione di adeguate prove scientifiche di sicurezza ed efficacia clinica.
- La responsabilità in capo agli Stati Membri di vigilare sulla sicurezza e di mettere in atto strumenti per la sostenibilità dell’innovazione.
- Un sistema sanitario dove l’offerta di tecnologie domina i meccanismi di scelta, che dovrebbero invece partire dalla reale domanda di salute dei cittadini.
La strategia per la governance dell’innovazione più consolidata definisce processi decisionali informati dalle valutazioni tecnico scientifiche. La sezione del documento sul governo della domanda e dell’offerta è pertanto quasi interamente dedicata all’Health Technology Assessment (HTA), strumento che favorisce lo sviluppo e l’innovazione, salvaguardando la sostenibilità dei sistemi sanitari universalistici e qualificando i processi di cura.
Le finalità del documento sono:
- fondare le decisioni sui bisogni dei pazienti e sul valore aggiunto di una tecnologia, dimostrato in termini di risultati;
- assumere rischi calcolati e solamente in presenza di potenziali benefici altamente rilevanti;
- rendere efficiente il monitoraggio dei rischi e dei benefici.
- comunicare all’industria i requisiti di sicurezza ed efficacia comparativa necessari per proporre prodotti innovativi.
Dal punto di vista delle relazioni le finalità sono:
- mettere a disposizione dei pazienti informazioni indipendenti e strumenti adeguati a supportarli nel comprendere i potenziali vantaggi e i potenziali rischi delle cure; di renderli partecipi ai processi decisionali affinché le valutazioni tengano conto delle loro prospettive e aspettative;
- salvaguardare le relazioni qualificate tra produttori e professionisti, ponendo questi ultimi nella condizione di poter richiedere evidenze cliniche di efficacia e sicurezza e contribuire a generarle attraverso la ricerca;
- migliorare le conoscenze dei produttori relative alle necessità del sistema sanitario; di incentivarli a condividere precocemente i piani di sviluppo delle proprie innovazioni per una migliore tempestività di risposta da parte del sistema.
L’UE adotta la Classificazione italiana dei dispostivi medici
Il ministro Grillo ha dichiarato: “siamo orgogliosi che la Commissione europea ha deciso di adottare il nostro sistema di classificazione nazionale come nomenclatore per la banca dati a livello europeo”.
Questo permetterà a tutti gli operatori italiani del settore dei dispositivi medici di risparmiare ingenti risorse economiche e strumentali per adattare la nomenclatura italiana a quella europea.
I Registri protesici, strumenti della Governance
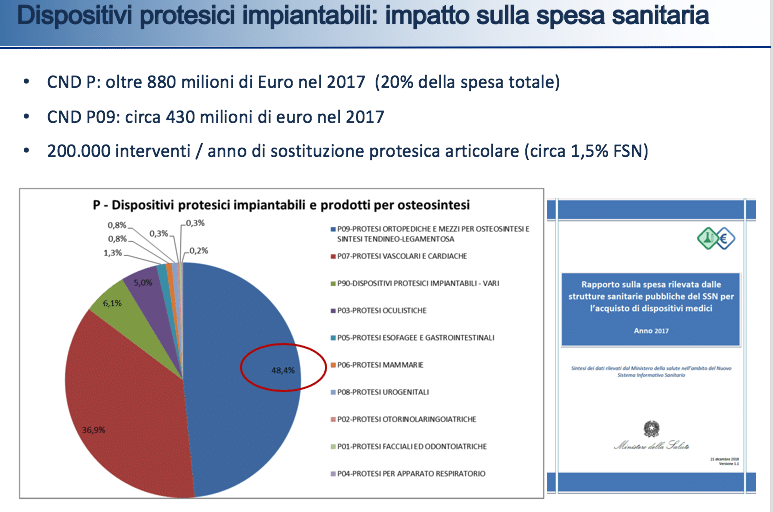
Il Registro Italiano ArtroProtesi (RIAP) è stato avviato oltre 10 anni fa dall’Istituto Superiore di Sanità su richiesta del ministero della Salute. Il RIAP rappresenta oggi una estesa rete di stakeholder che collaborano per creare una raccolta dati nazionale efficiente e di qualità. Informazioni su oltre 67.000 interventi di anca, ginocchio e spalla sono state raccolte nel 2017 in nove Regioni.
L’obiettico del Registro è creare un sistema di monitoraggio che copra tutto il territorio italiano, in grado di tracciare puntualmente tutte le protesi impiantate, valutarne la loro efficacia, indirizzare il chirurgo a scegliere quelle con evidenze di una maggiore durata e ad adottare buone pratiche.
Il numero di interventi di impianto di protesi ortopediche effettuati ogni anno nel nostro Paese sfiora i 200.000.
Il Registro nazionale delle protesi mammarie
La dottoressa Marcella Marletta, Direttore generale dei dispositivi medici e del servizio farmaceutico, ha annunciato l’attivazione a breve del Registro delle protesi mammarie. In questa fase pilota la partecipazione da parte dei chirurghi, che impiantano o espiantano protesi, è su base volontaria; seguirà la discussione in Conferenza Stato-Regioni del Regolamento del registro; successivamente il Registro, come previsto dalla Legge di bilancio, avrà carattere di obbligatorietà.
L’obbligatorietà e la trasparenza renderanno il registro italiano unico al mondo.
In Italia sono circa 51.000 le protesi mammarieimpiantate ogni anno. Il 63% ha finalità estetiche, il 37% finalità ricostruttive. Questi i dati che derivano dalle nostra attività di vigilanza, dati molto importanti che ci hanno dato la possibilità di stimare il numero di donne che ogni anno si sottopone ad impianto mammario: circa 35.000.
Il nuovo registro delle protesi mammarie permetterà:
- il monitoraggio clinico del soggetto sottoposto a impianto, allo scopo di prevenire le complicanze e migliorare la gestione clinico-assistenziale degli eventuali effetti indesiderati ed esiti a distanza;
- il monitoraggio epidemiologico, a scopo di studio e ricerca scientifica in campo clinico, biomedico e di programmazione, gestione, controllo e valutazione dell’assistenza sanitaria.
“Abbiamo utilizzato questi anni – ha dichiarato Marcella Marletta – per studiare meglio questa tipologia di dispositivi, ne abbiamo compreso meglio il mercato, abbiamo creato una solida rete con le regioni, le province Autonome, le società scientifiche ed i distributori di protesi mammarie sul territorio italiano ed oggi possiamo annunciare che già dalla prossima settimana si comincerà con la raccolta dei dati.
Il registro sarà così organizzato:
- i distributori comunicheranno quali e quante siano esattamente le protesi mammarie distribuite/ vendute sul territorio Italiano;
- i medici comunicheranno importanti informazioni cliniche che ci consentiranno il monitoraggio del paziente impiantato
Ministero della Salute – 22 marzo 2019
Notizie correlate: Dispositivi medici