Spetta all’AIFA e alla Commissione Tecnico Scientifica la definizione di innovatività, la sua valutazione ed il conferimento dello status di medicinale innovativo che presuppone la valutazione di tre elementi basilari: bisogno terapeutico, valore terapeutico aggiunto e robustezza delle prove scientifiche sottoposte dall’azienda a supporto della richiesta di innovatività. L’AIFA ha previsto che la valutazione di tale attributo debba avvenire tramite un modello unico per tutti i farmaci, ma consente, qualora si rendesse necessario, l’utilizzo 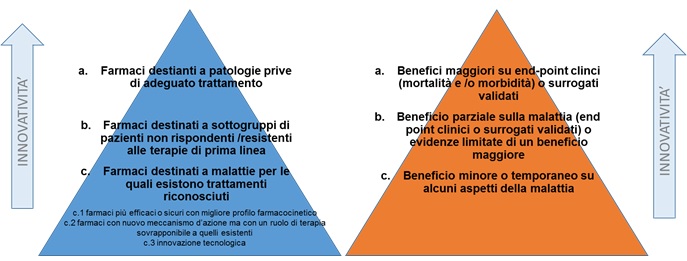
Criteri per la classificazione dei farmaci innovativi e dei farmaci oncologici innovativi
Con la determina n. 1535/2017 l’AIFA ha individuato i criteri per la classificazione dei farmaci innovativi e dei farmaci oncologici innovativi ai sensi dell’articolo 1, comma 402 della legge 11 dicembre 2016, n. 232.
PDF Allegato 2 – Modulo per la richiesta del riconoscimento dell’innovatività [0.39 Mb] >
L’Agenzia rende disponibili i report di valutazione per il riconoscimento dell’innovatività, per indicazione terapeutica,in ottemperanza a quanto disposto dalla Determina AIFA n.1535/2017.
Report di valutazione dell’innovatività per indicazione terapeutica (13/09/2019) [0.02 Mb] >
L’Aifa pubblica l’elenco aggiornato dei medicinali che, a giudizio della Commissione Tecnico Scientifica, possiedono il requisito della innovatività terapeutica/importante e/o innovatività terapeutica potenziale/condizionata, ai sensi dell’articolo 10, comma 2 della Legge n. 189/2012, come definito dall’art.1 comma 1 dell’accordo Stato Regioni del 18 novembre 2010 (Rep.Atti n.197/CSR).
PDF Elenco farmaci innovativi (Legge 189/2012) (10/09/2019) [0.24 Mb] >
