La pubblicazione del Regolamento ha ulteriormente amplificato il dibattito sul sistema della ricerca in Italia e sull’attrattività dell’Italia quale area geografica su cui investire in ricerca clinica. I dati del 2014 sono quindi il punto di partenza su cui ragionare per valutare fin da ora come lavorare affinché non si perda questa occasione unica di adeguamento del sistema alle esigenze attuale e, soprattutto dell’immediato futuro.
Guardando ai numeri, se i dati relativi al 2013 avevano dimostrato una generale tenuta dell’Italia nel settore delle sperimentazioni cliniche rispetto al resto d’Europa, i dati del 2014 mostrano addirittura una lieve tendenza all’aumento, con una ripresa generale anche sul totale delle sperimentazioni cliniche rispetto al resto d’Europa, sebbene le oscillazioni siano ridotte e necessitino di conferma negli anni successivi per trarre conclusioni più definitive.
THE
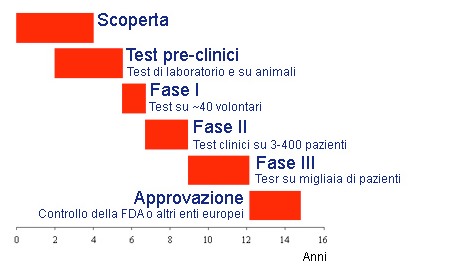
Le Sperimentazioni Cliniche (SC), così come i cosiddetti “usi speciali di farmaci non autorizzati”, costituiscono spesso una preziosa opportunità di cura per i pazienti, garantendo un accesso al farmaco precoce, in condizioni di monitoraggio stringente e, in ultima analisi, anche di risparmio per il Servizio Sanitario Nazionale. L’Agenzia Italiana del Farmaco crede nel valore della sperimentazione clinica e la identifica come una delle aree di maggiore crescita e interesse nel panorama regolatorio mondiale.
Leggi il 14° Rapporto nazionale sulla Sperimentazione Clinica dei medicinali in Italia
AIFA – Pubblicazioni – 28/12/2015
Related news: “Il regolamento (EU) 536/2014“, report e materiali del seminario ospitato dall’Istituto Superiore di Sanità
