Dopo l’approvazione da parte dell’Agenzia Europea dei Medicinali (EMA) del vaccino Moderna, la Commissione Tecnico Scientifica di AIFA si riunirà giovedì 7 gennaio 2021 per esaminare il dossier sull’autorizzazione all’immissione in commercio in Italia e definire le modalità di utilizzo nel SSN.

La società è attiva nell’ambito della ricerca e lo sviluppo di farmaci basati sull’RNA messaggero (mRNA).
Il 16 novembre 2020 l’azienda ha annunciato la scoperta di mRNA-1273, un vaccino a RNA per far fronte alla pandemia di COVID-19 del 2019-2021, per il quale ha dichiarato un’efficacia del 94,5%, lo 0,5% in meno rispetto al vaccino di BioNTech e Pfizer, rispetto al quale, però, è di più facile conservabilità.
La molecola di mRNA è solitamente contenuta in un mezzo per la somministrazione di farmaci, come le nanoparticelle lipidiche, per proteggere i fragili filamenti di mRNA e favorire la loro entrata nelle cellule umane. La fragilità della molecola di mRNA richiede una distribuzione nella catena del freddo e conservazione a bassa temperatura, e può compromettere l’efficacia effettiva a causa di dosaggi inadeguati. Il vaccino Moderna però rimane stabile a temperature standard di refrigerazione tra 2 e 8 gradi C per 30 giorni. Inoltre, si prevedono condizioni di trasporto e conservazione a lungo termine a temperature standard del congelatore di -20 gradi C per 6 mesi
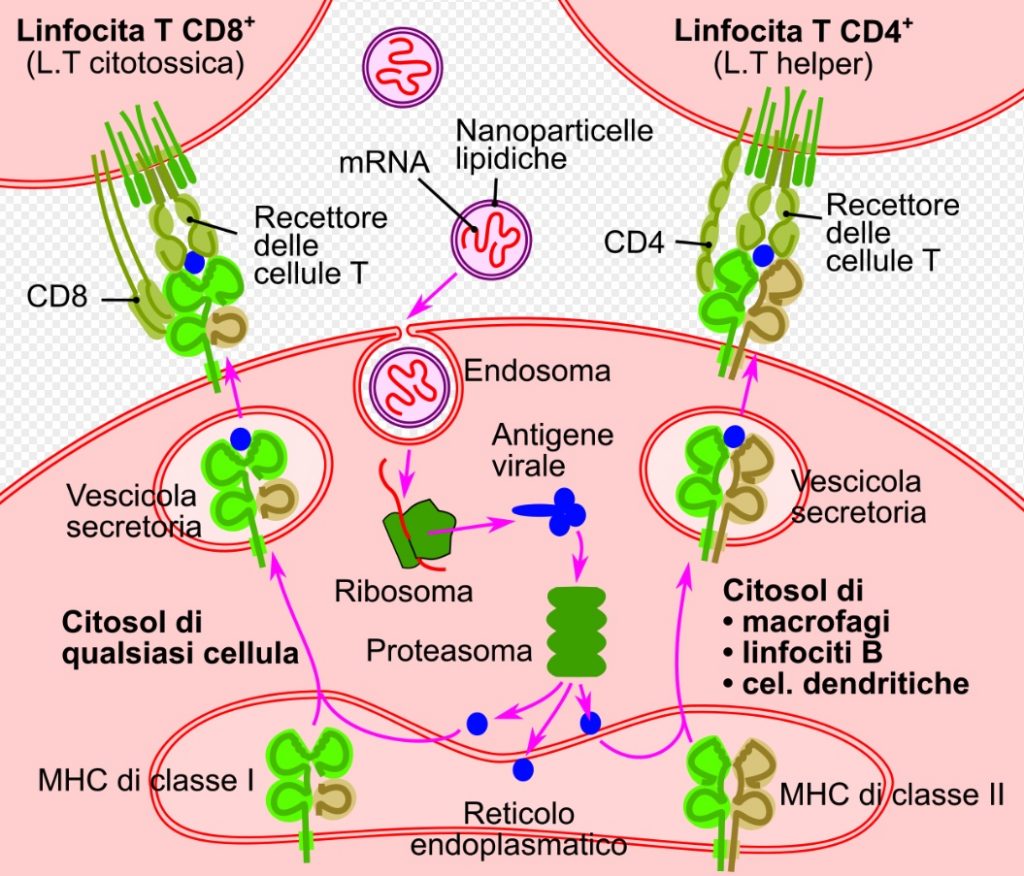
l sistema di somministrazione del mRNA-1273 utilizza un sistema di rilascio del farmaco con nanoparticelle lipidiche.
Moderna si affida a società ed organizzazioni esterne che operano su licenza per aumentare la produzione del vaccini: ha stipulato un contratto con Lonza Group per la produzione del vaccino presso le strutture di Portsmouth negli USA e Visp, in Svizzera. Per il riempimento e confezionamento delle fiale, Moderna ha stipulato contratti con Catalent negli Stati Uniti e Laboratorios Farmacéuticos Rovi in Spagna.
Il 18 dicembre 2020, mRNA-1273 ha ricevuto l’autorizzazione per l’uso in casi emergenzali dalla Food and Drug Administration degli Stati Uniti. In seguito ne è stato autorizzato l’uso in Canada dal 23 dicembre 2020.
A fine 2020 Moderna ha ottenuto degli accordi di acquisto del suo vaccino con l’Unione Europea per 160 milioni di dosi e con il Canada per un massimo di 56 milioni di dosi. Complessivamente, nei prossimi tre mesi, giungeranno in Italia 1,3 milioni di dosi Moderna, con cadenza settimanale: 100mila a gennaio, 600mila a febbraio e 600mila a marzo.
Il 6 gennaio 2021 è stato autorizzato al commercio in Europa dall’Agenzia europea per i medicinali.
Notizie correlate: EMA. COVID-19 Vaccine Moderna
EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU
AIFA. Comunicato Stampa n. 623 [0.14 Mb] >