La nuova normativa europea sui dispositivi medici subirà un rinvio dell’entrata in vigore. Il Governo ha infatti stabilito di chiedere una delega al Parlamento per l’approvazione di un decreto che riordini l’intera normativa e la coordini con il nuovo Regolamento UE. Solo con la definitiva approvazione di tale decreto, prevista per il 2021, partiranno gli adempimenti a carico delle farmacie.
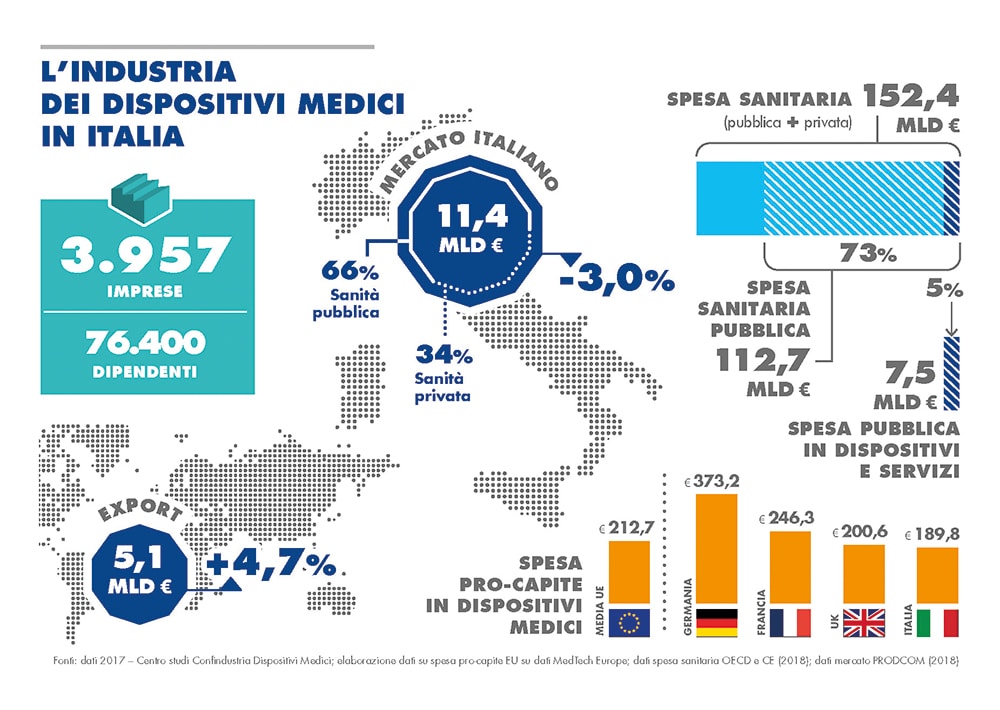 Tale rinvio comporta la conseguenza di spostare in avanti di 4 anni l’entrata in vigore di gran parte della nuova normativa sui dispositivi medici, in quanto solo ai medical device che hanno deciso, a partire dal maggio 2017, di intraprendere la strada della certificazione ex Regolamento 2017/745, verranno applicate le nuove disposizioni in vigore dal 26 maggio 2020. Tali dispositivi dovrebbero essere ben pochi in considerazione del fatto che sono pochissimi in Europa (in Italia al momento soltanto uno ndr) gli organismi notificatori certificati secondo le nuove specifiche del Reg. 2017/745.
Tale rinvio comporta la conseguenza di spostare in avanti di 4 anni l’entrata in vigore di gran parte della nuova normativa sui dispositivi medici, in quanto solo ai medical device che hanno deciso, a partire dal maggio 2017, di intraprendere la strada della certificazione ex Regolamento 2017/745, verranno applicate le nuove disposizioni in vigore dal 26 maggio 2020. Tali dispositivi dovrebbero essere ben pochi in considerazione del fatto che sono pochissimi in Europa (in Italia al momento soltanto uno ndr) gli organismi notificatori certificati secondo le nuove specifiche del Reg. 2017/745.
Queste le novità per quanto riguarda le questioni propriamente regolatorie, ovvero il décalage di almeno 4 anni, dalla data del 26 maggio 2020, dell’effettiva applicazione della normativa alla quasi totalità dei dispositivi medici in commercio.
Vi è anche, però, una seconda novità in merito a questioni più strettamente amministrative, ovvero, nello specifico, il coordinamento tra le nuove disposizioni direttamente applicabili del Regolamento UE ed il Decreto legislativo attualmente in vigore (n. 46/97). Simmetricamente, la medesima operazione verrà svolta per i dispostivi medici in vitro normati dal Regolamento europeo gemello n.2017/746.
Di interesse anche la definizione di un sistema sanzionatorio che dovrà essere efficace, dissuasivo e proporzionato alla gravità delle violazioni.
Ugualmente di interesse, l’individuazione delle “modalità di tracciabilità dei dispositivi medici attraverso il riordino delle banche dati esistenti in conformità al Sistema unico di identificazione del dispositivo (sistema UDI) previsto dai regolamenti (UE) 2017/745 e 2017/746”.
Il fatto che il nostro Paese abbia potuto godere di una deroga, fino al 9 febbraio 2025, per l’effettiva implementazione della tracciabilità del farmaco etico ad uso umano potrebbe, tuttavia, creare un problema alle farmacie in merito all’effettiva implementazione della normativa sulla tracciabilità dei dispositivi medici.
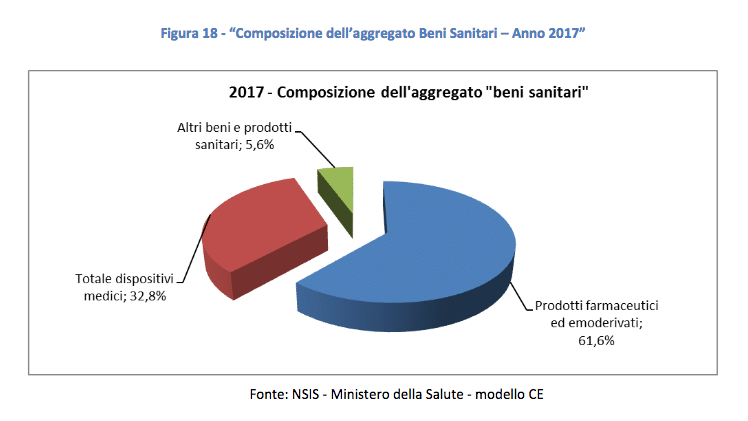 Infine, le norme che il Governo dovrà approvare nel suddetto Decreto Legislativo riguarderanno anche questioni di governance economica della spesa pubblica relativa ai medical device. Il Governo avrà a disposizione 12 mesi di tempo per adottare i suddetti Decreti legislativi. In considerazione del fatto che il Disegno di legge di delegazione europea impiega, in media, 7 mesi (dalla sua definitiva approvazione in Consiglio dei Ministri) per essere pubblicato in Gazzetta Ufficiale, è ipotizzabile che le nuove norme nazionali sui dispositivi medici difficilmente vedranno la luce prima dell’estate del 2021.
Infine, le norme che il Governo dovrà approvare nel suddetto Decreto Legislativo riguarderanno anche questioni di governance economica della spesa pubblica relativa ai medical device. Il Governo avrà a disposizione 12 mesi di tempo per adottare i suddetti Decreti legislativi. In considerazione del fatto che il Disegno di legge di delegazione europea impiega, in media, 7 mesi (dalla sua definitiva approvazione in Consiglio dei Ministri) per essere pubblicato in Gazzetta Ufficiale, è ipotizzabile che le nuove norme nazionali sui dispositivi medici difficilmente vedranno la luce prima dell’estate del 2021.
Infine, la questione di alcuni software utilizzati dalle farmacie che dovranno ora essere registrati, per la prima volta, come dispositivi medici (ad esempio i servizi di telemedicina o quelli che permettano alla farmacia di fornire il servizio di aderenza alla terapia ai propri pazienti).
Federfarma ha inviato, a riguardo, specifico quesito al Ministero della salute per poter avere dei chiarimenti sulle modalità da seguire al fine di ottenere la certificazione per tali prodotti. Inoltre, abbiamo ribadito, nella medesima lettera, la nostra disponibilità ad essere convocati per poter fornire il contributo della categoria in vista della definizione dei decreti legislativi in parola.
Notizie correlate: D.Lgs. 46/97