
Nella produzione e nella R&S delle aziende del farmaco, la digital transformation ha raggiunto livelli anche più elevati che in altri comparti manifatturieri del made in italy. Ampi margini di miglioramento, invece, ci sono nella governance dei dati e della loro integrità, sia a livello d’infrastrutture e sistemi sia di processi e soluzioni
ZeroUno – 16 agosto 2018 – di Giuseppe Aliverti
Più investimenti, più produzione, più export: a partire dal 2010 l’industria farmaceutica italiana è entrata in una fase espansiva che ha portato il settore a diventare una punta di diamante della nostra economia e a fare da traino anche per i diversi settori dell’indotto.
Negli ultimi sette anni, l’ambito farmaceutico è risultato primo in Italia per crescita della produzione (+13%), dell’export (+52%) e della produttività (+19%). Con 30 miliardi di euro di fatturato (il 72% circa sviluppato dall’export), la produzione italiana vale il 25% del totale di quella europea (figura 1). Sono 64.000 gli addetti diretti (6.200 in Ricerca e Sviluppo) e 66.000 nell’indotto. Oltre il 50% dei ricercatori è costituito da donne, e circa 3.000 gli addetti in più dal 2014.
L’escalation del Pharma made in Italy è valsa la conquista di un posto d’onore in Europa, e non solo: l’Italia è un hub internazionale per la produzione di farmaci e vaccini (secondo in Europa alla sola Germania) e punta a diventare a breve un 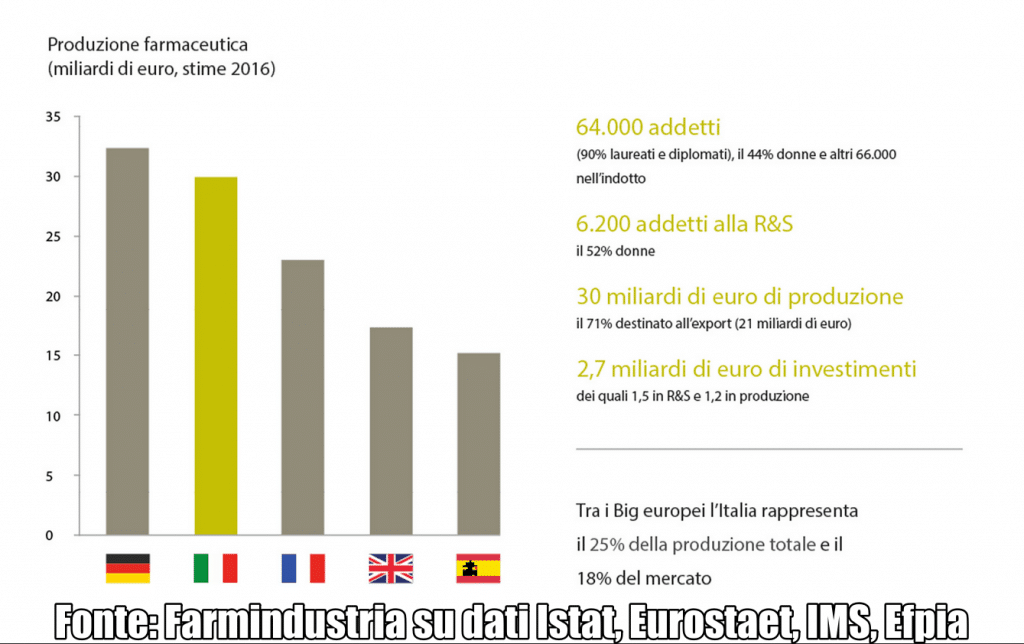 hub continentale anche per gli studi clinici.
hub continentale anche per gli studi clinici.
Tutti risultati raggiunti soprattutto grazie alla politica d’investimenti di molte aziende: non solo cospicui ma anche, in buona parte, mirati e lungimiranti. In particolare, la spesa in tecnologie digitali ha raggiunto in questi anni i 6,5 miliardi di euro (stime Farmindustria, l’Associazione delle imprese del farmaco). Solo nel 2016, le aziende del settore hanno investito 2,7 miliardi di euro (1,5 in R&S e 1,2 in produzione), con una crescita nel triennio di 450 milioni.
“L’industria farmaceutica italiana – spiega Alberto Bartolini, Coordinatore Area Supply Chain di Afi-Associazione Farmaceutici Industria – ha saputo allinearsi per tempo al cambiamento di prospettiva del settore a livello globale. L’evoluzione sociodemografica dei Paesi a economia più avanzata da un lato, con il prolungamento delle aspettative di vita, i  progressi fatti dalla medicina dall’altro (per esempio nella cura delle cosiddette ‘malattie rare’, di quelle autoimmuni e delle intolleranze alimentari e nella lotta antitumori) hanno portato a un ripensamento complessivo dei farmaci e del loro utilizzo. Dal paradigma dell’‘one drug fits all’ si va passando alla concezione di farmaci tailor made: la formulazione, la produzione, il dosaggio e le modalità di somministrazione potranno tener conto delle condizioni effettive, e misurabili, del paziente. In estrema sintesi, il medicinale entrerà a far parte di un circolo virtuoso e interattivo di soluzioni integrate con gli strumenti diagnostici e i servizi sanitari. Una rivoluzione in cui hanno un ruolo essenziale i sistemi e le soluzioni digitali, dal cloud all’IoT, dalle blockchain alle stampanti 3D fino all’augmented reality. E difatti si parla già da tempo di Pharma 4.0”.
progressi fatti dalla medicina dall’altro (per esempio nella cura delle cosiddette ‘malattie rare’, di quelle autoimmuni e delle intolleranze alimentari e nella lotta antitumori) hanno portato a un ripensamento complessivo dei farmaci e del loro utilizzo. Dal paradigma dell’‘one drug fits all’ si va passando alla concezione di farmaci tailor made: la formulazione, la produzione, il dosaggio e le modalità di somministrazione potranno tener conto delle condizioni effettive, e misurabili, del paziente. In estrema sintesi, il medicinale entrerà a far parte di un circolo virtuoso e interattivo di soluzioni integrate con gli strumenti diagnostici e i servizi sanitari. Una rivoluzione in cui hanno un ruolo essenziale i sistemi e le soluzioni digitali, dal cloud all’IoT, dalle blockchain alle stampanti 3D fino all’augmented reality. E difatti si parla già da tempo di Pharma 4.0”.
La centralità del dato
Oggi, l’80% dei macchinari e degli impianti in uso nelle aziende italiane è integrato o integrabile in modalità 4.0. Nei prossimi tre anni, secondo una recente indagine svolta da Farmindustria con Bain & Company, oltre i due terzi delle aziende continueranno a investire in tecnologie digitali, con punte dell’88% nella produzione e del 71% nella R&S.
“Sul fronte produttivo e, più in generale, della supply chain – rimarca Bartolini – le questioni centrali sono quelle dell’integrità e della governance dei dati, e lo saranno sempre di più, per la necessità di garantire sicurezza, trasparenza e convalidabilità delle informazioni a ogni livello e in ogni mercato, che comportano numerose e complesse attività di compliance nelle aziende, e i relativi controlli ispettivi dell’Aifa, Agenzia italiana del farmaco”.
Oggi gli standard produttivi, i sistemi di verifica, l’efficienza e l’affidabilità della supply chain delle nostre imprese sono garantiti, certificati e riconosciuti a livello globale: altrimenti non esporteremmo il 72% della produzione. Ma sul piano della trasmissione e della gestione dei dati ci sono ancora ampi spazi di miglioramento sia in termini d’infrastrutture e di sistemi sia di processi e di soluzioni: a fianco di aziende ampiamente informatizzate anche su questo fronte, non poche sono le imprese che gestiscono l’enorme massa di dati necessari con procedure e approcci ‘ibridi’, dove ancora si fa uso, più o meno esteso, di documentazione cartacea. Il ricorso a soluzioni di blockchain parrebbe la strada migliore e più veloce per garantire l’integrità e la riservatezza dei dati e prevenire i rischi di cyber attack.
 “Ma c’è una spinta ancora più impellente a digitalizzare quei dati e quei processi finora esclusi e rimasti ‘sulla carta’ – avverte Bartolini –: è ormai alle porte il 9 febbraio 2019, quando per i produttori farmaceutici europei entrerà in vigore l’obbligo di serializzazione, imposto dalla Direttiva 2011/62/Ue. Verrà cioè assegnato un numero seriale univoco, connesso a dati di produzione individuali (tra cui l’identificazione del prodotto, la data di scadenza nonché il numero del lotto, ndr) sotto forma di codice a barre bidimensionale a matrice”.
“Ma c’è una spinta ancora più impellente a digitalizzare quei dati e quei processi finora esclusi e rimasti ‘sulla carta’ – avverte Bartolini –: è ormai alle porte il 9 febbraio 2019, quando per i produttori farmaceutici europei entrerà in vigore l’obbligo di serializzazione, imposto dalla Direttiva 2011/62/Ue. Verrà cioè assegnato un numero seriale univoco, connesso a dati di produzione individuali (tra cui l’identificazione del prodotto, la data di scadenza nonché il numero del lotto, ndr) sotto forma di codice a barre bidimensionale a matrice”.
Una misura decisa per rafforzare tracciabilità e sicurezza dei farmaci da un lato, e per combattere, dall’altro, il commercio mondiale di medicinali falsificati e illegali, ingigantitosi con la diffusione di Internet. Essendosi già dotata di un sistema di tracking dei farmaci, all’Italia è stata riconosciuta dalla Ue una proroga di sei anni, fino al 2025. Ma le aziende italiane premono per l’allineamento a febbraio 2019 alla Direttiva Ue: altrimenti si troveranno a gestire un doppio regime, per il mercato nazionale e per l’export, con inutile aggravio di costi, di tempi e di risorse.
“In ogni caso – sottolinea Bartolini – qui l’affidabilità delle infrastrutture e dei sistemi informativi nella trasmissione e convalida dei dati sarà più che essenziale: basterà un errore nella stampa, nella lettura o nell’invio del codice per mettere a rischio non solo il prodotto, ma anche l’intero lotto di produzione, che diventerà invendibile come il singolo farmaco”.
Per monitorare la readiness delle imprese su tale fronte ed evidenziare le carenze da affrontare e risolvere, a fine 2017 è stata condotta un’indagine da Afi-Associazione Farmaceutici Industria su un campione di 200 associati tra aziende e operatori della filiera, i cui risultati saranno presentati in autunno in un evento ad hoc.
“Come dato non del tutto positivo – commenta Bartolini – va segnalata la presenza marginale della funzione IT (5%): un’incidenza troppo modesta se si considera quale sarà lo scenario previsto in ottica 4.0. Le risposte fornite su temi quali la convalida dei sistemi, l’integrità dei dati, la governance dell’infrastruttura ICT lasciano intravvedere una situazione in cui i margini di miglioramento sono molto ampi. Ci vuole un sostegno più autorevole del top management delle aziende, per promuovere nel management un cambiamento culturale che preveda un passaggio dall’approccio dipartimentale a quello trasversale (team working), il consolidamento di processi di Governance ICT, e per dotarsi di strumenti tecnologici adeguati e adeguatamente gestiti in grado di accogliere le prossime sfide del mercato, a cominciare appunto dalla tracciabilità e dalla serializzazione”.
Sul fronte della R&S aumenterà in modo rilevante il ruolo dei farmaci first in class (quelli cioè che danno vita a una nuova classe di prodotti) e dell’innovazione “beyond the pill”, che pone il farmaco in un’interazione continua con device, e-health e altri strumenti. Si estenderanno, poi, le attività e i progetti più di frontiera, quali terapie personalizzate, malattie rare, biotecnologie, medicina di genere. E avrà modo di affermarsi, infine, la R&S basata sugli esiti clinici dei farmaci: la cosiddetta “Real World Evidence”. Impegni che le aziende farmaceutiche per lo più affrontano stringendo accordi di collaborazione e di open innovation con partner di altri settori. A cominciare dalle imprese ICT, con cui attivare sinergie nella medicina di precisione partendo dall’utilizzo dei Big Data, ivi compresi i dati biomedici ottenuti dai dispositivi wearable.
Note: Per supply chain s’intende un sistema di organizzazioni, persone, attività, informazioni e risorse coinvolte nel processo atto a trasferire o fornire un prodotto o un servizio dal fornitore al cliente. Comincia con le materie prime, continua con la realizzazione del prodotto finito e la sua gestione di magazzino, e termina con la fornitura del prodotto finale al cliente. L’intero iter è diviso in vari step, e in ogni step sono coinvolte diverse figure professionali: Marketing; Rapporti con i fornitori; Approvvigionamenti; Gestione e stoccaggio scorte materie prime; Produzione; Gestione e stoccaggio delle scorte di prodotti finiti; Gestione ordini d’acquisto; Gestione delle consegne; Logistica di ritorno.
IoT, acronimo dell’inglese Internet of things, è un neologismo riferito all’estensione di Internet al mondo degli oggetti e dei luoghi concreti. Gli oggetti (le “cose”) si rendono riconoscibili e acquisiscono intelligenza grazie al fatto di poter comunicare dati su se stessi e accedere ad informazioni aggregate da parte di altri. Per esempio i flaconi delle medicine avvisano i familiari se ci si dimentica di prendere il farmaco. Tutti gli oggetti possono acquisire un ruolo attivo grazie al collegamento alla Rete.
La blockchain, in italiano “catena di blocchi”, può essere semplificata come un processo in cui un insieme di soggetti condivide risorse informatiche (memoria, CPU, banda) per rendere disponibile alla comunità di utenti un database virtuale. Le Blockchain si candidano al ruolo di applicazione chiave per l’Industrial IoT. La tecnologia in questione può essere utilizzata per tracciare miliardi di dispositivi collegati, consentendo l’elaborazione delle transazioni che questi producono e il coordinamento tra i device fisici.
Per realtà aumentata, o realtà mediata dall’elaboratore, si intende l’arricchimento della percezione sensoriale umana mediante informazioni, in genere manipolate e convogliate elettronicamente, che non sarebbero percepibili con i cinque sensi. Può essere utilizzata per ottimizzare la realizzazione di un progetto senza che sia necessario costruire fisicamente un prototipo. In questo modo l’azienda risparmierà tempo e soprattutto molto denaro.
La stampante 3D, nuova tecnologia utilizzata per la produzione di oggetti inserendo l’apposito materiale nel macchinario, viene vista da molti come l’inizio dell’industria 4.0. La quarta rivoluzione industriale. Può essere utilizzata in ogni ambito. La tecnologia della stampa 3D promette considerevoli risparmi nel ciclo produttivo dei farmaci. L’FDA ha approvato una formulazione in compresse a rapida disgregazione prodotta con stampante 3D del farmaco antiepilettico levetiracetam (Spritam). E’ il primo farmaco ad essere prodotto con la tecnologia della stampa in 3D. Durante la produzione, la stampante 3D distribuisce strati di farmaco in polvere e un agente legante in forma liquida che lega fra loro i vari strati. Poiché non vengono utilizzate forze di compressione per la produzione delle “compresse” stampate in 3D, il farmaco risulta solido ma poroso.





