
Per patent linkage si intende quella pratica tramite cui l’autorizzazione all’ammissione in commercio, la definizione del prezzo, l’ammissione alla rimborsabilità dei farmaci e/o qualsiasi altra autorizzazione relativa a un farmaco generico viene posta in una condizione di subordinazione rispetto allo status del brevetto del prodotto originario di riferimento.
 Con il decreto Balduzzi (D.l. 13 settembre 2012, n. 158, convertito, con modificazioni, in legge 8 novembre 2012 n. 189) il nostro Paese ha introdotto nuovamente un condizionamento brevettuale. Nello specifico veniva disposto che “… in sede di periodico aggiornamento del Prontuario farmaceutico nazionale, i medicinali equivalenti, ai sensi di legge, ai medicinali di cui è in scadenza il brevetto o il certificato di protezione complementare non possono essere classificati come farmaci a carico del Servizio sanitario nazionale con decorrenza anteriore alla data di scadenza del brevetto o del certificato di protezione complementare, pubblicata dal Ministero dello sviluppo economico ai sensi delle vigenti disposizioni di legge“.
Con il decreto Balduzzi (D.l. 13 settembre 2012, n. 158, convertito, con modificazioni, in legge 8 novembre 2012 n. 189) il nostro Paese ha introdotto nuovamente un condizionamento brevettuale. Nello specifico veniva disposto che “… in sede di periodico aggiornamento del Prontuario farmaceutico nazionale, i medicinali equivalenti, ai sensi di legge, ai medicinali di cui è in scadenza il brevetto o il certificato di protezione complementare non possono essere classificati come farmaci a carico del Servizio sanitario nazionale con decorrenza anteriore alla data di scadenza del brevetto o del certificato di protezione complementare, pubblicata dal Ministero dello sviluppo economico ai sensi delle vigenti disposizioni di legge“.
Una tale disposizione sembra ostacolare una concorrenza diretta con i farmaci coperti da brevetto e disincentivare fortemente le farmaceutiche produttrici di generici dal commercializzare la propria versione prima della scadenza dei diritti di esclusiva.
Il 1° luglio 2019 è entrato in vigore il Regolamento (UE) 2019/933 che ha modificato il Regolamento (CE) n. 469/2009 prevedendo alcune eccezioni alla tutela prevista dal certificato di protezione complementare (CCP) per i medicinali, con l’espresso obiettivo di promuovere la competitività delle industrie di farmaci generici e biosimilari aventi sede nel territorio dell’UE. Il Regolamento UE ha introdotto per queste industrie la possibilità di produrre una versione generica o biosimilare di un medicinale protetto da certificato durante il periodo di validità dello stesso, circoscrivendo l’applicazione della deroga per la fabbricazione (il c.d. SPC manufacturing weaver, in Italia CCP)
l’Agcm ha più volte evidenziato la necessità di abrogare la norma che subordina l’inserimento dei medicinali equivalenti nel Prontuario farmaceutico nazionale da parte di Aifa (ai fini del rimborso a carico del Ssn) alla scadenza del brevetto o del certificato di protezione complementare dei medicinali di riferimento.
Con il Ddl Concorrenza 2021 sembrava raggiunto tale scopo. Infatti, l’articolo 15 (Rimborsabilità dei farmaci equivalenti) del suddetto disegno di legge abrogava definitivamente il vincolo introdotto nel decreto Balduzzi. Ciò significa che per l’accesso al mercato dei farmaci generici e per la loro rimborsabilità a carico del Servizio sanitario nazionale non bisogna attendere la scadenza del brevetto o del Certificato Protettivo Complementare (CPC).
Tale svolta è stata vista sicuramente con favore da Egualia (già Assogenerici), ossia l’organo di rappresentanza ufficiale dell’industria dei farmaci generici equivalenti. Secondo l’associazione l’abrogazione del patent linkage “non lede in alcun modo la tutela brevettuale garantita dalle norme comunitarie, ma consente ai produttori di equivalenti di espletare tutte le procedure negoziale per il prezzo e rimborso per essere pronti ad entrare in commercio appena scaduto il brevetto, consentendo una corretta ed equa concorrenza”.
Farmindustria invece aveva espresso molta perplessità e preoccupazione per l’abrogazione del patent linkage, ritenendola un forte disincentivo per la ricerca farmaceutica con ripercussioni negative anche sulla salute dei pazienti e una mancanza di tutela degli investimenti effettuati da parte delle imprese farmaceutiche che  producono farmaci “branded“
producono farmaci “branded“
Ora la Commissione Industria del Senato ha approvato la Proposta di modifica n. 15.4 (testo 2) al DDL n. 2469 dei senatori Conzatti, Sbrollini e altri che ripristina il “Patent Linkage”. In sostanza l’Aifa una volta che il produttore di farmaci avrà completato tutte le procedure per ottenere la rimborsabilità del medicinale da parte del Ssn, dovrà valutare anche l’eventuale copertura brevettuale residua.
15.4 (testo 2) [id. a 15.5 (testo 2), 15.7 (testo 2), 15.8 (testo 2), 15.10 (testo 2)]
Conzatti, Sbrollini Rizzotti, Conzatti, Marti, Boldrini, Perosino Marti, Mollame, Pianasso, Pietro Pisani e altri.
Accolto
Sostituire l’articolo con il seguente:
(Rimborsabilità dei farmaci equivalenti)
-
- All’articolo 11 del decreto-legge 13 settembre 2012, n. 158, convertito, con modificazioni, dalla legge 8 novembre 2012, n. 189, il comma 1-bis è abrogato.
- I produttori di farmaci equivalenti ai sensi delle vigenti disposizioni, possono presentare all’AIFA istanza di rilascio dell’autorizzazione all’immissione in commercio (AIC), nonché istanza per la determinazione del prezzo e la classificazione ai fini della rimborsabilità del medicinale prima della scadenza del brevetto o del certificato di protezione complementare.
- I farmaci equivalenti di cui al comma 2 possono essere rimborsati a carico del Servizio sanitario nazionale a decorrere dalla data di scadenza del brevetto o del certificato di protezione complementare sul principio attivo, pubblicata dal Ministero dello sviluppo economico ai sensi delle vigenti disposizioni di legge».
Egualia ha pubblicato il 26 maggio la seguente nota:
Resta il Patent Linkage. La maggioranza ha scelto di tradire i pazienti e il SSN
 In Commissione Industria al Senato passa il dietrofront sulla cancellazione dello strumento anti concorrenza prevista nel testo presentato dal Governo
In Commissione Industria al Senato passa il dietrofront sulla cancellazione dello strumento anti concorrenza prevista nel testo presentato dal Governo
«Prendiamo atto con profondo sconcerto della scelta della maggioranza, in commissione Industria al Senato, di tradire ancora una volta l’interesse dei pazienti italiani e dell’intero Servizio sanitario nazionale mantenendo inalterato nel nostro ordinamento il meccanismo del Patent Linkage che invece l’art. 15 del DDL Concorrenza mirava ad abrogare».
Ad affermarlo è Enrique Häusermann, presidente di EGUALIA – associazione delle aziende produttrici di generici equivalenti, biosimilari e value added medicines – commentando l’approvazione di una riformulazione dell’articolo 15 del Ddl Concorrenza che – in aperta violazione dei principi espressi dalla normativa comunitaria – continua a mantenere in vita i “paletti” che in un decennio hanno causato oltre 220 milioni di mancati risparmi per il servizio sanitario pubblico, oltre che incertezze e costi aggiuntivi per le imprese del settore.
«Nonostante le ripetute sollecitazioni dell’Antitrust, l’ultima risalente al marzo 2021, e nonostante l’orientamento ormai consolidato della giurisprudenza amministrativa – prosegue Häusermann – a causa di una scelta anacronistica del legislatore, AIFA, nel valutare i farmaci equivalenti per stabilirne la classe di rimborsabilità non dovrà tener conto solo di ciò che è di sua competenza – qualità sicurezza ed efficacia – ma dovrà continuare, unica in Europa, a considerare anche la copertura brevettuale.
«Si tratta di una completa inversione di rotta rispetto alla cancellazione del Patent Linkage inizialmente contenuta nel testo presentato dal Governo, spacciata come un presunto compromesso tra le esigenze del comparto dei generici e quelle del comparto degli originator. Ci tengo a dirlo con chiarezza, non è un  compromesso, è una totale retromarcia. La riformulazione prevista, infatti, perpetua la situazione già in essere da dieci anni, totalmente sbilanciata a favore di interessi protezionistici di alcuni comparti industriali. Ne è prova che l’Unione Europea sta procedendo a varare importanti riforme sul regolamento che disciplina i certificati di protezione complementare, oggetto di ripetuti abusi ed ingiustificate estensioni dei monopoli che da essi derivano, come facilmente si evince dai documenti preparatori della Pharma Strategy annunciata dalla Commissione Europea nel 2021».
compromesso, è una totale retromarcia. La riformulazione prevista, infatti, perpetua la situazione già in essere da dieci anni, totalmente sbilanciata a favore di interessi protezionistici di alcuni comparti industriali. Ne è prova che l’Unione Europea sta procedendo a varare importanti riforme sul regolamento che disciplina i certificati di protezione complementare, oggetto di ripetuti abusi ed ingiustificate estensioni dei monopoli che da essi derivano, come facilmente si evince dai documenti preparatori della Pharma Strategy annunciata dalla Commissione Europea nel 2021».
«In questo momento di grave difficoltà economica che i cittadini italiani ed europei e le autorità sanitarie si trovano ad affrontare dovrebbe essere di cruciale importanza agevolare l’accesso ai trattamenti meno costosi senza inutili ostacoli. A maggior ragione la scelta compiuta dalla politica su questo argomento risulta ingiustificata – conclude Häusermann – Garantiamo fin d’ora che daremo visibilità e informazioni dettagliate ai cittadini su qualsiasi danno economico che sarà subito dal SSN a causa della mancata abrogazione del Patent Linkage, nonché di ogni altro effetto negativo per la concorrenza che possa derivare da questa scelta infelice».
Notizie correlate: Patent linkage e industria farmaceutica: le novità nel Ddl Concorrenza 2021
Regime brevettuale dei farmaci
Certificato di Protezione Complementare
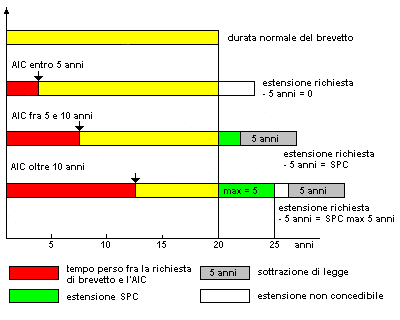
Nota: In Italia il CCP (Certificato Complementare di Protezione), concede un prolungamento dei tempi di protezione per un massimo di ulteriori 5 anni, oltre i 20 anni dalla data di deposito della domanda di brevetto. Esso consente il recupero, almeno parziale, della durata effettiva del brevetto.
Per calcolare il CCP si contano gli anni che trascorrono dal deposito della domanda di brevetto e il rilascio dell’AIC, e a essi si sottrae un numero di anni pari a 5. Il valore ottenuto, che deve comunque essere minore o uguale a 5, corrisponde al numero di anni da sommare alla vita residua del brevetto.





