
Il dottor Tedros Adhanom Ghebreyesus, Direttore Generale dell’Organizzazione mondiale della sanità  (OMS), ha accolto la famiglia Lacks per un incontro speciale presso la sede dell OMS a Ginevra. L’evento è stato trasmesso in diretta e comprende la presentazione di un premio speciale postumo a Henrietta Lacks, riconoscendo la sua eredità e il suo contributo alla scienza medica che ha cambiato il mondo. L’Organizzazione mondiale della sanità (Oms) ha deciso di conferire un’onorificenza e nominare ‘madre della medicina moderna’ Henrietta Lacks. Il riconoscimento è stato ricevuto nella sede dell’Oms a Ginevra dal figlio 87enne della donna, insieme ai suoi nipoti e altri membri della famiglia.
(OMS), ha accolto la famiglia Lacks per un incontro speciale presso la sede dell OMS a Ginevra. L’evento è stato trasmesso in diretta e comprende la presentazione di un premio speciale postumo a Henrietta Lacks, riconoscendo la sua eredità e il suo contributo alla scienza medica che ha cambiato il mondo. L’Organizzazione mondiale della sanità (Oms) ha deciso di conferire un’onorificenza e nominare ‘madre della medicina moderna’ Henrietta Lacks. Il riconoscimento è stato ricevuto nella sede dell’Oms a Ginevra dal figlio 87enne della donna, insieme ai suoi nipoti e altri membri della famiglia.
Sono intervenuti
- Dr Tedros Adhanom Ghebreyesus, WHO Director-General
- Lawrence Lacks, Henrietta Lacks’ son
- Alfred Lacks Carter, Jr, Henrietta Lacks’ grandson
- Victoria Baptiste, Henrietta Lacks’ great granddaughter
- Professor Senait Fisseha, Co-Chair, Director-General’s Expert Group on Cervical Cancer Elimination
- Professor Groesbeck Parham, Co-Chair, Director-General’s Expert Group on Cervical Cancer Elimination
- Dr Princess Nothemba (Nono) Simelela, Assistant Director-General and Special Advisor for Strategic Priorities at WHO.
- Dr Soumya Swaminathan, WHO’s Chief Scientist
Chi è Henrietta Lacks
Henrietta Lacks (Roanoke, 1º agosto 1920 – Baltimora, 4 ottobre 1951) è stata una donna statunitense afroamericana morta a causa di un tumore, il cui nome è legato a una linea cellulare denominata HeLa.
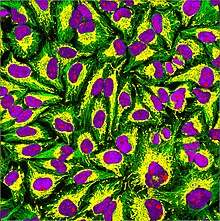
 Durante una biopsia le furono prelevate alcune cellule tumorali uterine, successivamente commercializzate con il nome HeLa. Tali cellule sono ad oggi una delle più importanti e diffuse scoperte nell’ambito della ricerca medica genetica, grazie ad alcune caratteristiche che le rendono speciali. Le cellule di Henrietta Lacks riproducevano un’intera generazione in sole 24 ore, e per questo sono dette naturalmente ‘immortalizzate’, possono cioè essere trasmesse in vitro senza morire. Le HeLa, oltre al normale corredo cromosomico umano (ogni cellula umana normale contiene 23 coppie di cromosomi, per un totale di 46 cromosomi), presentano quattro copie del cromosoma 12 e tre copie dei cromosomi 6, 8, e 17. Tale differenza nel corredo cromosomico è dovuta ad una mutazione orizzontale indotta dal Papillomavirus, che è responsabile di quasi la totalità dei carcinomi cervicali. Queste caratteristiche genetiche sono dovute al fatto che l’enzima telomerasi è stato mutato dal virus del papilloma umano e ciò consente alle cellule di non invecchiare mai.
Durante una biopsia le furono prelevate alcune cellule tumorali uterine, successivamente commercializzate con il nome HeLa. Tali cellule sono ad oggi una delle più importanti e diffuse scoperte nell’ambito della ricerca medica genetica, grazie ad alcune caratteristiche che le rendono speciali. Le cellule di Henrietta Lacks riproducevano un’intera generazione in sole 24 ore, e per questo sono dette naturalmente ‘immortalizzate’, possono cioè essere trasmesse in vitro senza morire. Le HeLa, oltre al normale corredo cromosomico umano (ogni cellula umana normale contiene 23 coppie di cromosomi, per un totale di 46 cromosomi), presentano quattro copie del cromosoma 12 e tre copie dei cromosomi 6, 8, e 17. Tale differenza nel corredo cromosomico è dovuta ad una mutazione orizzontale indotta dal Papillomavirus, che è responsabile di quasi la totalità dei carcinomi cervicali. Queste caratteristiche genetiche sono dovute al fatto che l’enzima telomerasi è stato mutato dal virus del papilloma umano e ciò consente alle cellule di non invecchiare mai.
Le HeLa sono oggi coltivate in laboratori di tutto il mondo per fini scientifici e, sebbene siano trattate come cellule tumorali, esse posseggono delle caratteristiche uniche, che le differenziano dalle altre cellule di questo tipo. Le HeLa sono molto più resistenti delle altre cellule tumorali e sono in grado di sopravvivere in condizioni che altre cellule non possono tollerare; sono in grado di vivere per un periodo relativamente lungo anche in assenza di terreno di coltura. Le HeLa possono dividersi molte più volte rispetto alle altre cellule e ciò dipende da una mutazione della telomerasi, che previene l’accorciamento del telomero durante la replicazione, cosa che nelle altre cellule provoca la morte dopo un certo numero di divisioni cellulari.
Grazie alle cellule di Henrietta oggi abbiamo il vaccino contro la poliomielite, abbiamo strumenti molto più potenti contro il cancro della cervice e molti altri tipi di tumore, nuovi farmaci contro l’Aids, l’emofilia, il Parkinson. Sappiamo assai di più sugli effetti delle radiazioni cosmiche sulle cellule umane e anche su cosa succede all’organismo in condizioni di microgravità (sono state portate anche sui satelliti).
Si sono fatti progressi sulle malattie genetiche. Le ricerche sulla fertilità e la procreazione assistita le devono moltissimo, e la medicina di precisione sta raggiungendo successi insperati proprio grazie a lei. Persino i vaccini contro Covid-19 devono molto a questa donna. Ma lei, Henrietta Lacks nata Loretta Pleasant il 1 agosto 1920, tutto questo non lo ha mai saputo.
A consentire questi avanzamenti nella ricerca sono state infatti solo le sue cellule, prelevate a sua insaputa nel 1951 dai medici del Johns Hopkins Hospital di Baltimora cui si era rivolta per la sua malattia. Dopo essere state prelevate dalla paziente tramite biopsia, parte del tessuto tumorale fu acquisito dal laboratorio di coltura di tessuti presso lo stesso Johns Hopkins Hospital diretto dal dr. George Otto Gey (1899-1970), noto per diverse scoperte e innovazioni in quest’ambito. Nel 1999, si è scoperto che il genoma di tali cellule era mutato per la presenza del virus del papilloma umano e che tale mutazione aveva determinato la loro capacità di non invecchiare.
 A causa della loro straordinaria capacità di crescita, sin dal 1966 si è scoperto anche che le HeLa avevano contaminato diverse altre colture cellulare nei laboratori di tutto il mondo. Esse infatti possono essere inavvertitamente trasferite ad altre colture attraverso particelle di polvere, goccioline respiratorie (meglio note col nome inglese di “air droplets”), o a causa di una non perfetta sterilizzazione delle mani degli operatori o dei loro strumenti.
A causa della loro straordinaria capacità di crescita, sin dal 1966 si è scoperto anche che le HeLa avevano contaminato diverse altre colture cellulare nei laboratori di tutto il mondo. Esse infatti possono essere inavvertitamente trasferite ad altre colture attraverso particelle di polvere, goccioline respiratorie (meglio note col nome inglese di “air droplets”), o a causa di una non perfetta sterilizzazione delle mani degli operatori o dei loro strumenti.
Da un punto di vista etico, la questione principale risiede nel fatto che le cellule di Henrietta furono utilizzate a scopo di ricerca senza che lei lo sapesse, né tantomeno ne diede esplicito consenso. Sebbene all’epoca ciò fosse del tutto legale, la questione ha generato, negli anni successivi e ancora oggi, diverse dispute di natura bioetica.
La famiglia di Hernietta, inoltre, restò all’oscuro dell’utilizzo e della diffusione delle cellule HeLa fino al 1973, cioè qualche anno dopo la morte del dr. Gey, che si era ben guardato dal rivelare il nome della paziente. La situazione si è ulteriormente complicata solo pochi anni fa, cioè nel 2013, quando il genoma delle cellule è stato divulgato in una banca dati pubblica, comportando, con ciò, una violazione della privacy dei familiari ancora viventi che, ovviamente, in parte condividono quello stesso genoma. È stato quindi raggiunto un accordo con i familiari che ha permesso il mantenimento della conoscenza pubblica dei dati.
Naturalmente, la raccolta di informazioni personali, biologiche e molecolari dei pazienti è un elemento imprescindibile verso lo sviluppo di una medicina sempre più di precisione e personalizzata. Un’ulteriore questione è quella di un eventuale riconoscimento finanziario dei “proprietari” dei tessuti che vengono utilizzati a scopo di ricerca. Diversi scienziati ritengono sia giusto pagare i donatori consenzienti e alcuni istituti di ricerca stanno riflettendo se e come riparare a simili errori nel passato.
 Il Direttore Generale del’OMS, Ghebreyesus, alla conclusione del suo discorso celebrativo ha detto che le tecnologie mediche che hanno avuto origine da quel primo furto sono state utilizzate per perpetuare altre ingiustizie: le conoscenze che ne sono derivate non sono state condivise in modo equo nel mondo. Nei paesi in cui il cancro della cervice è più diffuso non ci sono dosi sufficienti di vaccino contro l’HPV, il papillomavirus, che rappresenta la principale causa di questo tumore [ndr: oggi le donne di colore continuano ad essere colpite dal tumore del collo dell’utero ad un tasso 7 volte superiore a quello delle donne bianche]. E anche i vaccini contro Covid-19, che pure devono molto alle linee cellulari HeLa, non sono stati distribuiti a sufficienza nei paesi a medio e basso reddito. Per questo – ha concluso Ghebreyesus – oggi dobbiamo sanare questa ingiustizia rendendo onore a Henrietta. Anche nella salute e nella scienza, black lives matters.
Il Direttore Generale del’OMS, Ghebreyesus, alla conclusione del suo discorso celebrativo ha detto che le tecnologie mediche che hanno avuto origine da quel primo furto sono state utilizzate per perpetuare altre ingiustizie: le conoscenze che ne sono derivate non sono state condivise in modo equo nel mondo. Nei paesi in cui il cancro della cervice è più diffuso non ci sono dosi sufficienti di vaccino contro l’HPV, il papillomavirus, che rappresenta la principale causa di questo tumore [ndr: oggi le donne di colore continuano ad essere colpite dal tumore del collo dell’utero ad un tasso 7 volte superiore a quello delle donne bianche]. E anche i vaccini contro Covid-19, che pure devono molto alle linee cellulari HeLa, non sono stati distribuiti a sufficienza nei paesi a medio e basso reddito. Per questo – ha concluso Ghebreyesus – oggi dobbiamo sanare questa ingiustizia rendendo onore a Henrietta. Anche nella salute e nella scienza, black lives matters.
Notizie correlate: WHO. Henrietta Lacks: Recognizing Her Legacy Across the World
TV Svizzera. Oms riconosce contributo di Henrietta Lacks a scienza





