FORUM SULL’INFORMAZIONE
SCIENTIFICA
coordinato da Giampaolo Velo e Giuseppe Recchia
Farmaco, salute, informazione, pubblicità
Giampaolo Velo1, Giuseppe Recchia2
1Università di Verona, Direttore Reference Centre for Education and Comunication within the WHO Programme for International Drug Monitoring, Verona
2Direttore Medico & Scientifico GlaxoSmithKline, Verona
La storia della Medicina e quella della réclame sono intimamente connesse, tanto da potersi – con una certa fedeltà di immagine – concepire come due campi di luce e di ombra sfumanti, nel tempo, l’uno nell’altro attraverso una zona fluttuante di chiaroscuro.
Con questa affermazione, Stanislao Silingardi introduceva la seconda parte del saggio analitico critico L’affare della réclame in medicina, nel quale approfondiva i complessi rapporti tra terapia, informazione e pubblicità nei primi del Novecento (1).
Dopo oltre un secolo, questa complessità permane ed anzi risulta ancora maggiore, in relazione alla dimensione multipla degli interessi coinvolti e della evoluzione tecnologica.
Informazione e Pubblicità
L’informazione è un elemento essenziale per la promozione della salute e della terapia. Educazione Sanitaria, Formazione Medica, Informazione Scientifica hanno un ruolo primario nel migliorare la conoscenza della malattia e la adesione alla terapia da parte dei cittadini, consentire di acquisire nuove conoscenze e di apprendere nuove informazioni sulla malattia e sulla sua gestione da parte degli operatori sanitari.
In conseguenza sia della com- plessità tecnologica che della di- mensione e degli interessi economici (seppure spesso inferiori a quelli delle tecnologie diagnostiche) correlati al farmaco, la gran- de parte della discussione su informazione e pubblicità è centrata sull’uso del farmaco.
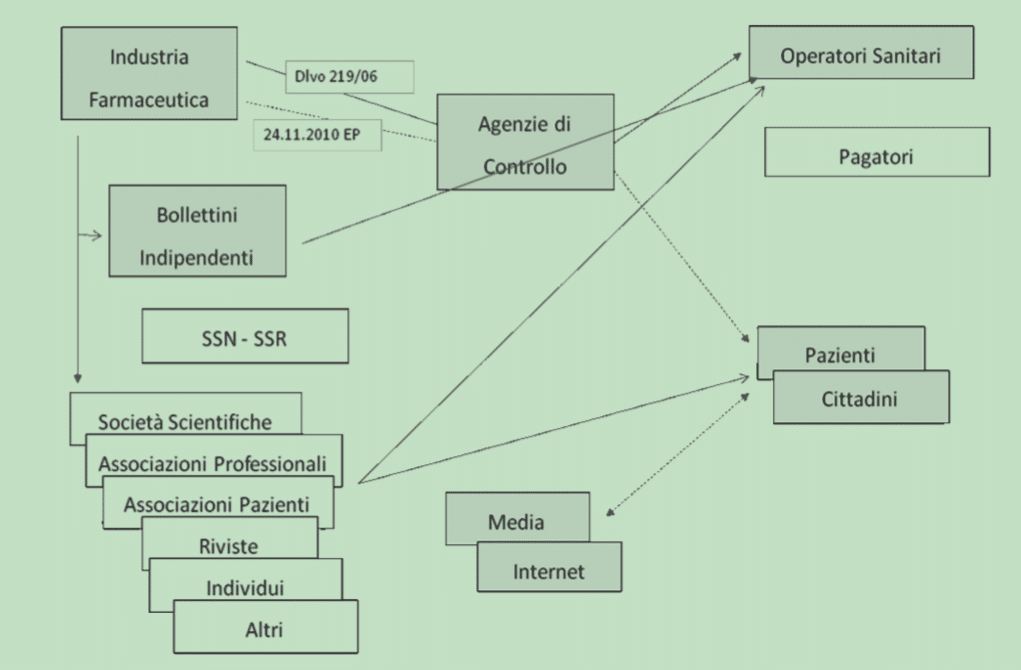
L’informazione scientifica sul farmaco è un fattore essenziale per l’uso razionale dei farmaci. Per tale ragione è importante che tale informazione risulti obiettiva, basata sulle migliori conoscenze scientifiche e trasferibile nell’ambito della pratica clinica.
La tipologia dell’informazione
scientifica sul farmaco può essere promozionale (e pertanto rientra- re nell’ambito della pubblicità) o non promozionale in relazione alla natura del soggetto che eroga tale informazione ed alle intenzioni correlate a tale erogazione. Quando tale intenzione è “promuovere la prescrizione e il consumo di medicinali”, l’informazione scientifica si configura come pubblicità. Per pubblicità si intende un enunciato verbale o scritto che mira a inco- raggiare la prescrizione da parte di operatori sanitari e l’impiego dei farmaci da parte dei cittadini, generalmente mettendo in luce le caratteristiche del farmaco (claims o “dichiarazioni sul prodotto”). Le normeescludonodataledefinizione il materiale di consultazione, le asserzioni o gli annunci di carat- tere informativo su dati di fatto, i cataloghi commerciali e i listini prezzi, sempre che questi non pro- pongano claims sul prodotto.
Informazione Scientifica a Finalità Pubblicitaria
È pertanto l’intenzione in via primaria e non tanto la qualità oppure il contenuto della infor- mazione che opera tale differenza. Di conseguenza la medesima informazione può essere classificata come a finalità pubblicitaria oppure come informazione senza tale finalità, in relazione alle caratteristiche sopra esposte. L’informazione senza finalità promozionale alla quale oggi può acce- dere sia il medico che il cittadino può risultare di qualità limitata e può determinare effetti nocivi. A differenza della informazione non promozionale, per la quale non esiste alcuna forma di controllo e di assicurazione della qualità se non occasionali forme di auto- controllo e di certificazione ter- za, la informazione pubblicitaria è oggetto di controllo e verifiche da parte delle autorità regolatorie e sanitarie, a livello nazionale e
talora regionale ed aziendale, in- tese a garantire il rispetto di una serie di standard minimi e che sia basata sulle migliori conoscenze scientifiche e trasferibile nell’am- bito della pratica clinica. Come sottolinea nel proprio articolo Pa- olo Rizzini, la promozione è am- messa a condizione che rispetti le disposizioni normative vigenti in materia. Non deve, pertanto, contenere elementi tali da suscitare nel cittadino aspettative non realistiche né risultare ingannevole e/o fuorviante. I medicinali non pos- sono essere considerati prodotti di consumo qualunque, pertanto la pubblicità ad essi collegata necessita di un particolare riguardo con dovute cautele e precauzioni.
I farmaci sono dotati della potenzialità di nuocere tanto quanto di produrre effetti benefici e le informazioni necessarie al loro utilizzo sono collegate direttamente alla potenzialità di provocare anche gravi problemi alla salute. Ogni forma di pubblicità e di promozione dei farmaci deve essere responsabile e rispettare gli standard più elevati al fine di garantirne l’impiego razionale ed oculato, sia che il prodotto sia destinato all’automedicazione, sia che la sua somministrazione ri- chieda la supervisione di personale medico. Le norme stabiliscono i requisiti e le restrizioni che interessano sia la pubblicità indirizzata a chi deve prescrivere o fornire farmaci al pubblico, sia la pubblicità diretta al pubblico. L’aspetto rilevante, a tale riguardo, è determinato dalle di- sposizioni normative vigenti (titolo VIII “Pubblicità” del D.lgs. 219/06) che:
1) vietano la pubblicità rivolta al pubblico dei farmaci soggetti a prescrizione medica
2) vietano ogni forma di pubblicità di medicinali non autorizzati
3) richiedono che la pubblicità sia conforme al RCP
4) richiedono sia favorito l’uso razionale del farmaco e sia evitata ogni ingannevolezza.
La definizione della pubblicità
che si applica ai farmaci non è limitata a specifici mezzi di comunicazione e pertanto comprende articoli pubblicati su riviste, settimanali e quotidiani, grafiche su manifesti e avvisi, fotografie, film, trasmissioni radio o televisive, videoregistrazioni, trasmissioni elettroniche, materiale pubblica- to su web: siti internet, newsletter online, e-alert, podcasting, convegni e congressi ed altro.
Recenti esperienze di certificazione della qualità della informazione scientifica e promozione della informazione scientifica collaborativa potrebbero rappresentare delle modalità di miglioramento degli standard qualitativi.
Esperienze di Certificazione della Informazione Scientifica sul Farmaco
Ai fini dell’appropriatezza prescrittiva è fondamentale che il principale vettore di informazione scientifica sui farmaci, l’Industria produttrice, sia portatore di informazioni complete, corrette e adeguatamente documentate. Data la rilevanza del tema, è stato realizzato un sistema pilota di gestione per la qualità ISO 9001:2000 in merito al processo di progettazione, sviluppo e diffusione della comunicazione ed informazione scientifica (3).
All’interno del progetto sono stati sviluppati degli standard tecnici relativi ai contenuti del supporto scientifico utilizzato nell’informazione scientifica che viene trasmessa agli operatori sanitari. I principi ispiratori nel definire gli standard tecnici del contenuto scientifico sono stati quelli delle discipline propedeutiche al campo dell’informazione scientifica, come l’Evidence Based Medicine. In pratica viene raccomandato l’uso appropriato (in termini di completezza e correttezza) delle migliori informazioni disponibili, creando dei criteri minimi di inclusione ed esclusione e preparando anche una precisa gerarchia delle stesse.
Questi principi obbligano ad una particolare attenzione nell’esplicitazione e valutazione delle fonti, in termini di tipologia e qualità dello studio che ha originato il dato o il claim, forza dell’evidenza prodotta ed indipendenza delle informazioni stesse. L’applicazione di tutto questo determina una produzione e diffusione di tutte le informazioni disponibili su un farmaco attraverso un sistema che necessariamente ne documenta un uso appropriato, e nell’ambito di un contesto standardizzato ed in un formato che permetta una verifica indipendente e critica delle fonti da parte degli utenti dell’informazione. Tutto il processo viene controllato da Enti certificatori esterni, attraverso un sistema oggettivo e misurabile mediante indicatori di proces- so e tecnici di risultato, finalizzato al miglioramento continuo di tale tematica.
Esperienze di Informazione Scientifica Collaborativa
La informazione scientifica condotta in collaborazione tra impresa del farmaco e società scientifiche, associazioni mediche, aziende sanitarie locali o regioni rappresenta un elemento di assicurazione della qualità e di ampliamento delle finalità della informazione scientifica promozionale.
Il razionale di tale modalità de- riva dalla consapevolezza della ri- levanza per il medico di essere in grado di:
- – accedere a tutta l’informazione disponibile relativa ai problemi rilevanti per la propria attività professionale su malattia e te- rapia
- – distinguere i diversi livelli qua- litativi della informazione di- sponibile
- – identificare rapidamente l’informazione di maggior rilevanza per la propria professioneL’informazione scientifica colla- borativa rappresenta pertanto un
nuovo modello informativo inteso a definire i principi per la analisi dei bisogni informativi, la selezio- ne ed elaborazione del contenuto informativo, la erogazione della in- formazione scientifica sui farmaci in accordo alle vigenti normative e secondo modalità che consentano l’utilizzo di diversi canali informativi, quali visite individuali, incontri collegiali, web e canali telematici. Esperienze pilota condotte nella Azienda ULSS 12 Veneziana e in fase di pianificazione nella Regione Puglia nell’ambito del progetto Quadro hanno confermato a livello preliminare la fattibilità di questa modalità.
Le Nuove Tecnologie
Web (che nel 2011 ha celebrato i primi 20 anni), social network, smartphone stanno rivoluzionan- do le modalità di distribuzione, ac- cesso e fruizione dell’informazio- ne, compresa quella relativa ai far- maci. L’evoluzione della dimensio- ne quantitativa della informazione scientifica non si è accompagnata ad una pari evoluzione della di- mensione qualitativa, aprendo una serie di problemi nuovi ed inattesi.
Comunicazione al Cittadino
Il tema della comunicazione di- retta al cittadino da parte dell’im- presa del farmaco è stato oggetto in Europa di diverse iniziative, intese a consentire, impedire o limitare le possibilità. Una dichia- razione di Erice sulla comunica- zione promozionale sui farmaci ai consumatori ha evidenziato fin dal 2002 l’opportunità di assicurare forme di comunicazione senza fi- nalità promozionali, secondo mo- dalità diverse rispetto al modello statunitense (4).
Conclusioni
Il farmaco rappresenta un bene per la persona e per la società. L’informazione sull’uso del farmaco, sia promozionale che non promozionale, diretta al cittadino, all’operatore sanitario ed ai diversi attori della gestione della salute, ha un ruolo fondamentale nel promuovere il buon uso del farmaco. Iniziative di varia natura, soprattutto legislative, han- no indubbiamente contribuito a migliorare negli ultimi anni la qualità della informazione scientifica a finalità pubblicitaria. La complessità del sistema di informazione scientifica, caratterizzato da diversi erogatori, diversi canali, diversi destinatari è elevata e solo una costante opera di verifica e controllo può consentire di assicurare a cittadini e medici lo standard di qualità necessario per prendere le decisioni più appro- priate ai fini della gestione pro- pria o dei propri pazienti. L’approfondimento che viene condotto con le relazioni successive intende fornire un contributo per chiarire gli aspetti più complessi di questo quadro e per orientarne l’evoluzione in modo da migliorare la qualità dell’informazione.
BIBLIOGRAFIA
1. S. Silingardi. L’affare della réclame in medicina. Stab. Tip. Lit. F Apollonio 1909.
2. G. Apolone, M. Bassi, N. Buscone, P. Mosconi, P. Rizzini, V. Scarpino, G. P. Velo. Informazione Scientifica sul Farmaco: riflessioni ed indirizzi per una buona pratica. Economia e Politica del Farmaco, 2006.
3. P. Rizzini, A. Antonello, M. Farina. L’informazione scientifica? Facciamola con il bollino blu. Il Sole24Ore Sanità, 9.9.2003.
4. The Erice Statement on drug advertising to consumer. Erice 2002.
L’informazione scientifica sui farmaci in Italia: l’industria farmaceutica
Paolo Rizzini
Direttore Medico e Scientifico, ViiV Healthcare, Verona
L’informazione sui medicinali è indubbiamente un’attività estre- mamente rilevante ai fini del loro appropriato utilizzo, essendo i farmaci ed i vaccini elementi essen- ziali nel processo di prevenzione e cura, ed avendo anche impatto sull’organizzazione e sui costi diretti ed indiretti in sanità. Quello informativo è inoltre uno dei tre prodotti più importanti dell’indu- stria farmaceutica, insieme ai dati generati attraverso il processo di ricerca e sviluppo, ed ai medicinali prodotti attraverso i processi pro- duttivi industriali, ed ha lo scopo appunto di fornire informazioni relative ai propri farmaci al fine di promuoverne l’utilizzo. Poiché in Europa è tuttora di fatto vietata alle aziende la possibilità di fare infor- mazione sui farmaci da prescrizione diretta al cittadino, l’attenzione informativa è sempre stata rivolta al medico prescrittore ed al farma- cista, con un significativo impiego di risorse da parte dell’industria farmaceutica a livello internazionale, attraverso un investimento stimato intorno al 15-20% del fatturato, quando nell’intero sistema industriale la spesa media per pubblicizzare i propri prodotti è intorno al 2% (1, 2).
Data quindi l’importanza ed il ruolo che viene ad assumere l’informazione scientifica per il farmaco quando essa viene condotta da aziende farmaceutiche, essendo l’intento principale quello di promuovere l’appropriato utilizzo di farmaci di proprietà, essa viene inquadrata nel contesto delle attività di promozione e pubblicità e pertanto regolata da leggi nazionali, ed ora anche regionali, fin dal testo unico delle leggi sanitarie (art. 201) del 1934, cui sono seguite varie normative e decreti, fino a giungere al d.lgs. 219 del 2006, recepimento dell’ultima direttiva europea (2001/83/CE).
Il Titolo VIII del decreto tratta specificamente della promozione dei medicinali, riprendendo in buona misura quanto già previsto dal pre- cedente d.lgs. 541 del 1992, preve- dendo però anche la possibilità di legiferare in materia da parte delle singole regioni, ed annunciando più dettagliate norme operative da emanare attraverso una speci- fica linea guida dell’AIFA, ad oggi non ancora emessa, benché siano già circolate presso gli addetti ai lavori due diverse bozze della stessa. Anche in Italia la storia dell’informazione scientifica sul farmaco è quindi prevalentemente quella della promozione dei propri farmaci da parte delle aziende produttrici, e dei vari tentativi, più o meno riusciti, di regolamentarla da parte delle istituzioni centrali e regionali. L’investimento industriale in informazione scientifica negli anni è andato progressivamente aumentando, almeno fino al 2005, passando da complessivi 1283 milioni di euro nel 2000 a 2514 milioni nel 2005, cifra legata in grande prevalenza al costo com- plessivo delle visite degli informatori scientifici ai medici (l’84% del totale nel 2005), essendo il resto attribuibile ai costi per saggi medici, mezzi promozionali, pubblicità attraverso riviste scientifiche, organizzazione di eventi promozionali. Va anche però considerato che nello stesso periodo il numero di strumenti informativi e promo- zionali utilizzati dall’industria si è significativamente ridotto (vedi Tab. 1), ad indicare una maggiore focalizzazione dell’investimento in informazione su un numero inferiore di medicinali.
Se analizziamo, infatti, il livello occupazionale per ruolo nell’industria farmaceutica in Italia tra il 2006 ed il 2010 (Fig. 1), vediamo come, a fronte di un decremento occupazionale complessivo nell’industria farmaceutica italiana di circa l’11% (il totale degli occupati è passato da 74.726 unità nel 2006 a 66.700 nel 2010), la diminuzione del numero di informatori scientifici del farmaco è stata del 22,1%. È inoltre diminuita la percentuale di informatori all’interno delle aziende, passando dal 38% del 2007 al 32,8% del 2010. La Fig. 2 mette in evidenza il decremento numerico negli ultimi quattro anni (-19,6%), comparandolo alla invece sostanziale stabilità del personale dedicato alla ricerca e sviluppo (-0,6%), che ha pertanto aumentato il suo peso relativo (4).
A questo quadro d’insieme, va aggiunto che nel corso del 2011 e 2012, tra riduzioni già in corso e annunciate o stimate, si prevede una ulteriore diminuzione del numero di informatori scientifici del farmaco in Italia che si stima intorno alle 2000 unità, e continuerà ad esserci anche un riposizionamento degli informatori in attività dalle linee generalistiche (nelle quali prosegue una drastica riduzione) a quelle specialistiche ed ospedaliere, per le quali è previsto un aumento, sia in termini assoluti (circa +3%) che ovviamente relativi.
Ne deriva quindi la necessità di rivedere anche il modo in cui l’informazione scientifica viene erogata, passando sempre più dalla classica forma del “visual aid” stampato, più utile a trasferire informazioni concentrate, semplificate e generali, all’utilizzo diretto di fonti bibliografiche primarie, sia come reprint di stampa, che attraverso la navigazione tra le diverse fonti accreditate su supporti hardware come l’iPad, o su fonti già elaborate su web. L’informatore scientifico di questa nuova era della promozione dei medicinali deve avere quindi una solida preparazione, sia scientifica che sulle moderne tecniche di comunicazione, e basare sempre più il suo successo informativo sulla capacità di interlocuzione scientifica “alla pari”, invece che sulla relazione interpersonale consolidata.
La qualità dell’informazione scientifica delle aziende dovrà quindi migliorare anche nei contenuti, pur dovendosi mantenere in linea con i dettati normativi che la regolano strettamente, e che si spera evolvano concordemente alle nuove necessità informative. Bisogna infatti riconoscere che il miglioramento qualitativo dell’informazione scientifica, sia in Italia che a livello internazionale, non sembra sia significativamente progredito in linea con lo scenario precedentemente descritto. Uno studio pubblicato sul British Medical Journal nel 2004 (5), riportava infatti che un’analisi fatta su un campione di materiale promozionale utilizzato dall’industria farmaceutica in Germania era supportato da evidenze scientifiche solo nel 9% dei casi, ed uno studio fatto in Italia nel 2006 rilevava tra l’altro come solo il 63% dei medici ritenesse credibili le informazioni ricevute, e come un terzo ricevesse informazioni estratte direttamente da internet dagli informatori, senza una verifica qualitativa delle stesse da parte delle Direzioni Scientifiche delle aziende, e senza la necessaria preventiva sottomissione all’AIFA (6).
Del resto, un’indagine della FIMMG effettuata nel 2008 dimostrava che solo un terzo dei medici di famiglia italiani si considerava soddisfatto dell’informazione scientifica dell’industria, e ben l’82,5% riteneva che negli anni successivi il modo di fare informazione scientifica dovesse cambiare (7). Il problema sembra principalmente riferito ai contenuti informativi più che alle modalità di erogazione, venendo rilevato anche in altri settori promozionali come quello delle pagine promozionali pubblicate su riviste scientifiche dalle aziende farmaceutiche. Infatti, una metanalisi del 2009 (8) di studi pubblicati in 26 paesi sulla valutazione di questo tipo di promozione, rilevava che solo il 28% dei claim sostenuti potevano definirsi non ambigui, che meno del 67% di essi aveva un adeguato supporto di letteratura, e che tra le fonti bibliografiche a supporto esistevano ben il 17% di “data on file”, e il 15% di presentazioni a congressi, entrambi tipo di referenza considerata non adeguata e quindi non utilizzabile, per lo meno in molti paesi tra cui l’Italia.
Questa situazione non è accettabile soprattutto alla luce del fatto che la rilevanza a fini prescrittivi dell’informazione scientifica promozionale fatta dalle aziende è stata analizzata in diversi studi, ed una recente metanalisi di 57 pubblicazioni degli stessi (9) conferma come l’attività informativa promozionale effettuata attraverso diversi mezzi (visite degli informatori, partecipazione ad eventi promozionali, pubblicità su riviste scientifiche, informazioni per via postale) è direttamente associata a maggiore frequenza prescrittiva, aumento dei costi delle prescrizioni, e talora minore qualità delle stesse. Va ricordato come tutti questi studi abbiano chiari limiti metodologici, siano molto generali, spesso tengano principalmente conto della realtà non specialistica, siano stati principalmente realizzati in contesti regolatori e sanitari diversi uno dall’altro ed in tempi molto diversi, non tenendo conto dell’evolvere della materia normativa in proposito.
Rimane comunque il fatto che il principale problema da affrontare è quello della qualità del contenuto informativo, ed all’interno di questo quello della tipologia e qualità delle fonti bibliografiche utilizzate e della completezza delle informazioni fornite, essendo infatti indubbio che l’informazione trasmessa risulta talora ingannevole non tanto perché ci si sia stata qualche forma di manipola- zione dei dati presentati, ma attraverso l’omissione di dati rilevanti. Il problema di un’informazione fuorviante è estremamente rilevante, anche se spesso forse sottovalutato, se si considera il profilo di rischio per le aziende e per le Istituzioni, che va dalla violazione delle regole sulla pubblicità dei medicinali (d.lgs 219), ai danni all’erario a seguito di prescrizione di farmaci per indicazioni non registrate, al danno alla salute derivante dall’utilizzo non corretto di un farmaco a seguito di promozione non corretta o parziale. Va però anche evidenziato come in Italia, dopo l’istituzione dell’AIFA e la pubblicazione del d.lgs 219 del 2006, ci sia sicuramente stato un maggiore controllo e un conseguente miglioramento dell’informazione scientifica erogata dall’industria, anche se lo standard qualitativo è ancora difforme sia tra le varie aziende in Italia, che tra i diversi paesi europei, che interpretano spesso in modo differente i principi della Direttiva europea del 2001.
Nell’ambito del Gruppo ViiV Healthcare (vedi Tab. 2) è stata fatta un’indagine tra i direttori medici di diversi paesi sulle varie tipologie di fonti informative che si potevano utilizzare o meno nei documenti promozio- nali forniti agli informatori (presentazioni in congresso, poster a congresso, abstract su sito web, abstract pubblicati, articoli su riviste indicizzate, articoli su riviste non indicizzate, review da siti web di diversa estrazione, documenti regolatori, data on file, ecc.). I risultati hanno documentato una significativa variabilità tra i diversi paesi considerati: la situazione più restrittiva, e comunque più corretta in Europa, era quella francese ed italiana, che forse non a caso sono le uniche due realtà le cui normative prevedono una precisa responsabilità legale sulle attività promozionali in genere e sull’informazione scientifica in particolare attribuite ad un ben definito ruolo aziendale, in Italia quello del responsabile del servizio scientifico.
Il problema della qualità è stato affrontato direttamente anche dalle aziende, e Farmindustria il 25 luglio 2003 introduceva tra i suoi associati “l’obbligo di certificazione annuale relativamente alle procedure inerenti le attività di marketing e di informazione scientifica”, focalizzata però più alla verifica dei processi interni che non alla qualità stessa dei materiali promozionali.
Sono comunque stati fatti nel tempo anche tentativi di definire gli standard tecnici cui riferirsi per definire la qualità di un documento informativo, attraverso i quali si è poi arrivati anche ad una certificazione di qualità secondo standard ISO (10), che alcune aziende hanno poi seguito. Infine si è arrivati anche a proporre da più parti (11, 12), ad esempio già nel 1999 da parte della Società Italiana di Medicina Generale (SIMG), Federazione Nazionale degli Ordini dei Medici (FNOM) e Associazione Italiana Informatori Scientifici del Farmaco (AIISF), un osservatorio indipendente che valutasse la qualità dei contenuti dell’informazione scientifica, sia aziendale che “indipendente”, partendo da quella che dovrebbe essere la definizione di informazione scientifica, che per essere tale deve contemporaneamente essere oggettiva (basata su dati empirici), verificabile e riproducibile (prodotta con metodo scientifico) e accessibile (al fruitore dell’informazione e ad altre parti interessate) (13).
Un esempio di agenzia di revisione indipendente è il Pharmaceutical Advertising Advisory Board (PAAB) canadese, il cui ruolo primario è quello di assicurare che la comunicazione relativa ai prodotti sanitari per la prescrizione, non soggetti a prescrizione, prodotti sanitari biologici e naturali sia precisa, completa ed equilibrata, basata sulle migliori evidenze disponibili, monitorando inoltre la promozione dei diversi prodotti e la compliance alle normative vigenti (14).
A conclusione di questo breve resoconto sull’informazione scientifica (IS) dell’industria farmaceutica in Italia, ritengo si debbano sottolineare e ribadire alcuni punti, che dovrebbero essere considerati in una eventuale futura ed auspicabile agenda di lavori sull’argomento:
– l’IS sta rapidamente cambiando in funzione dello spostamento delle pipeline industriali dei farmaci verso settori specialistici e patologie a minore prevalenza e maggiori bisogni, e di nuove forme e mezzi di comunicazione, comportando una riduzione del numero di informatori e la necessità di una loro riqualificazione professionale;
– a fronte di questo cambiamento e della difformità di interpretazione dei principi normativi da parte di diverse aziende e delle diverse autorità regolatorie europee, si rende necessaria l’emanazione da parte di AIFA di una linea guida operativa che definisca standard qualitativi chiari, condivisi tra i diversi stakeholder, e che siano applicati da tutti gli erogatori di informazione scientifica (indipendenti, pubblici e privati),
– l’IS industriale deve sempre più confrontarsi con l’IS “indipendente”, che viene talora veicolata attraverso documenti di raccomandazione emanati anche da istituzioni regionali, come linee guida e percorsi terapeutici, che hanno un importante contenuto informativo sui medicinali, spesso difforme da regione a regione, e che talora danno indicazioni non in linea con quanto approvato a livello regolatorio, ed andrebbero quindi anch’essi verificati da un’agenzia regolatoria come l’AIFA (come recente esempio la raccomandazione sull’utilizzo degli inibitori della proteasi in monoterapia per il trattamento dell’HIV, uso non previsto nelle indicazioni approvate, contenuta in un Percorso Terapeutico regionale),
– andrebbe infine valutata la creazione di un osservatorio indipendente sull’informazione scientifica, che si faccia garante della qualità dell’IS sia a monte (documenti informativi), che a valle (survey sul medico) del processo informativo, supportato in modo paritetico dagli attori pubblici e privati a vario titolo interessati all’IS sul farmaco.
BIBLIOGRAFIA
1. Windmeijer F., De Laat E., Douven R. e Mot E., Pharmaceutical promotion and GP prescription behaviour, He- alth Econ., 15:5-18, 2006.
2. Indicatori Farmaceutici 2006, Centro Studi Farmindustria.
3. Indicatori Farmaceutici 2010, Centro Studi Farmindustria.
4. Indicatori Farmaceutici 2007-2010, Centro Studi Farmindustria.
5. Tuffs A., Only 6% of drug advertising material is supported by evidence, BMJ, 328: 485, 2004.
6. Velo GP. Bassi M., Apolone G., Rossi M.,
Buscone N., Scarpino V. e Rizzini P., Informazione scientifica sul farmaco: risultati di un’indagine pilota su un campione di medici di medicina gene- rale, Economia e Politica del Farma- co, 7: 13-19,2006.
7. Centro Studi FIMMG. Informatori scientifici: si può fare meglio. Avvenire Medico, 1: 8-12, 2008.
8. Othman N., Vitry A., Roughead EE, Quality of Pharmaceutical Advertisements in Medical Journals: A Syste- matic Review, PLoS ONE, 4(7): e6350, 2009.
9. Spurling G.K., Mansfield P.R., Mon- tgomery B.D., Lexchin J., Doust J. et al., Information from Pharmaceutical Companies and the Quality, Quantity, and Cost of Physicians’ Prescribing: A Systematic Review, PLoS Med, 7(10): e1000352, 2010.
10. Rizzini P., Antonello A. e Farina M., L’Informazione Scientifica? Faccia- mola con il bollino blu, Il Sole 24 Ore Sanità, 14-15, 9-15 sett. 2003.
11. Rivista SIMG, Ottobre 1999. Nuove Re- gole: nasce l’Osservatorio per l’Infor- mazione Scientifica. http://www.simg. it/documenti/rivista/1999/8_1999/9. pdf.
12. Velo G. P., Date un Osservatorio all’informazione sui Farmaci, Il Sole 24 Ore Sanità, 16-17, 24 agosto 2006.
13. Apolone G., Bassi M., Buscone N., Mosconi P., Rizzini P., Scarpino V. e Velo G. P., Informazione Scientifica sul Farmaco: riflessioni ed indirizzi per una buona pratica, Economia e Politica del Farmaco, 5: 30-35, 2005.
14. http://www.paab.ca/en/about_paab/mission/.
Quaderni della SIF (2012) vol. 29
N.d.R.:
Abbiamo riportato i soprastanti interventi al “Forum sull’Informazione Scientifica” trenutosi a Verona nel 2012, perché ancora attuali, soprattutto nel momento in cui è incredibilmente ancora in discussione la natura dell’Informatore Scientifico del Farmaco nel rinnovo del CCNL e probabilmente alla vigilia dell’emanazione delle linee guida dell’AIFA sull’informazione scientifica.
È bene precisare che la crisi occupazionale degli Informatori Scientifici del farmaco (ISF) fu programmata nel 2006 e attuata dal 2007 in avanti. Le motivazioni sopra riportate sono vere ma incomplete. È vero che le imprese farmaceutiche hanno deciso di abbandonare la medicina
Inoltre l’uso commerciale che hanno fatto fare agli ISF fino al 2006 con tagettizzazione dei medici, doppie visite, visite ripetute, speculari, ecc., ecc. hanno provocato nei destinatari dell’informazione una “crisi di rigetto”, tanto che un’indagine statistica sui medici dimostrava che la visita degli ISF era si e no ricordata dal 4% dai medici stessi. Troppo poco in relazione all’investimento praticato. Aumentavano i limiti d’accesso, si riduceva la durata di visita, era sempre più difficile differenziarsi e la produttività media di una vista si riduce significativamente (queste erano le analisi delle agenzie incaricate da Farmindustria). A questo si aggiungeva il sempre meno potere decisionale del medico di base sulla prescrizione che passava agli specialisti, agli ospedali, ai farmacisti, alle AUSL, alle Autorità regionali e di controllo. Tutti questi fattori insieme hanno provocato la riduzione, ad oggi, di circa il 50% degli ISF.
