
In questi giorni si è molto parlato del vaccino Pfizer. Ci sembra utile chiarire le caratteristiche di questo vaccino.
SARS-CoV-2 è un membro di una grande famiglia di coronavirus costituiti da particelle virali di forma sferica ricoperte da proteine spike che sporgono dalla loro superficie, che conferiscono al virus il suo aspetto simile a una corona.
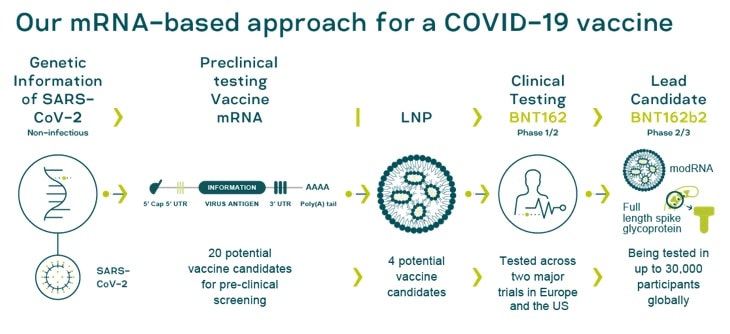 Questi picchi si legano alle cellule umane, consentendo al virus di infettarle. Il vaccino BioNTech Pfizer è costituito da un breve segmento di materiale genetico, chiamato RNA messaggero, che fornisce istruzioni a una cellula umana per realizzare una versione innocua di una proteina bersaglio, o immunogeno, che attiva la risposta immunitaria del corpo contro il virus SARS-CoV-2
Questi picchi si legano alle cellule umane, consentendo al virus di infettarle. Il vaccino BioNTech Pfizer è costituito da un breve segmento di materiale genetico, chiamato RNA messaggero, che fornisce istruzioni a una cellula umana per realizzare una versione innocua di una proteina bersaglio, o immunogeno, che attiva la risposta immunitaria del corpo contro il virus SARS-CoV-2
Ci aspettiamo che il nostro approccio vaccinale stimoli il sistema immunitario a generare anticorpi protettivi. Ciò significa che il sistema immunitario impara a riconoscere il virus SARS-CoV-2 al momento dell’esposizione e prevenire la successiva infezione.
L’obiettivo di un vaccino è stimolare il sistema immunitario a generare risposte protettive e di lunga durata di anticorpi e cellule T contro SARS-CoV- e prevenire la successiva infezione in seguito all esposizione al virus. I vaccini a mRNA sono una nuova potente classe evolutiva di vaccini con un potenziale di elevata versatilità e proprietà di sicurezza favorevoli.
Il 27 luglio, Pfizer e BioNTech hanno annunciato che, a seguito di un’ampia revisione dei dati preclinici e clinici degli studi clinici di Fase 1/2, e in consultazione con il Center for Biologics Evaluation and Research (CBER) della FDA e altri regolatori globali, le aziende hanno selezionato il candidato vaccino BNT162b2 per passare a uno studio di Fase 2/3. BNT162b2 codifica una glicoproteina (S) ottimizzata SARS-CoV-2 full-length spike glycoprotein (S), che è il bersaglio degli anticorpi neutralizzanti.
Nella fase finale della sperimentazione, Pfizer e BioNTech stanno studiando un dosaggio di 30 µg in un regime a 2 dosi su un massimo di 30.000 partecipanti di età compresa tra i 18 e gli 85 anni. Le aziende hanno selezionato circa 120 località a livello globale, comprese quelle in aree con una significativa trasmissione potenziale del virus SARS-CoV-2, e stanno lavorando per coinvolgere una popolazione eterogenea e arruolare i volontari a maggior rischio di infezione da virus. L’arruolamento di fase 2/3 della sperimentazione ha finora superato i 25.000 partecipanti con una seconda dose in corso.
 Ad una prima analisi di efficacia ad interim, il candidato vaccino ha dimostrato un’efficacia di oltre il 90% dopo 7 giorni dalla seconda somministrazione nel prevenire il COVID-19 nei partecipanti che non avevano evidenza di una precedente infezione da SARS-CoV-2. La sperimentazione è in corso, quindi la percentuale finale di efficacia potrebbe variare
Ad una prima analisi di efficacia ad interim, il candidato vaccino ha dimostrato un’efficacia di oltre il 90% dopo 7 giorni dalla seconda somministrazione nel prevenire il COVID-19 nei partecipanti che non avevano evidenza di una precedente infezione da SARS-CoV-2. La sperimentazione è in corso, quindi la percentuale finale di efficacia potrebbe variare
È importante segnalare che non si può richiedere l’autorizzazione alla FDA per l’uso in situazione di emergenza solo sulla base di questi risultati di efficacia che stiamo continuando a raccogliere nello studio clinico in corso.
In Pfizer stimano che una mediana di due mesi di dati sulla sicurezza, dopo la somministrazione della seconda e ultima dose del candidato vaccino – richiesta dalle linee guida della FDA per la potenziale autorizzazione all’uso di emergenza – sarà disponibile entro la terza settimana di novembre.
Pfizer sta inoltre generando dati per dimostrare che il vaccino può essere prodotto in modo da soddisfare gli standard di qualità. Efficacia, sicurezza e produzione sono i tre requisiti necessari prima di poter richiedere l’autorizzazione.
Il 9 settembre 2020 – Pfizer Inc. (NYSE: PFE) e BioNTech SE (Nasdaq: BNTX) hanno annunciato di aver concluso i colloqui preliminari con la Commissione Europea per una proposta di fornitura di 200 milioni di dosi del loro candidato vaccino sperimentale a base di mRNA BNT162 mRNA anti SARS-CoV2 agli Stati membri dell’Unione Europea (UE), con un’opzione di acquisto di ulteriori 100 milioni di dosi. Le consegne dovrebbero partire dalla fine del 2020, subordinate al successo clinico e all’autorizzazione o approvazione regolatoria.
“Se il nostro vaccino sarà approvato – ha dichiarato l’azienda farmaceutica in merito alla distribuzione internazionale – distribuiremo le dosi disponibili per il 2020 in maniera proporzionale a tutti quei Paesi con cui abbiamo già stipulato accordi di fornitura, che includono per tutti la consegna di una parte delle dosi prodotte già nel 2020”. All’Europa saranno infatti riservati 200 milioni di dosi, di cui circa 27 milioni saranno riservati all’Italia. Saranno circa 14 i milioni di italiani, dunque, che potranno usufruirne, poiché per essere efficace il vaccino prevede una doppia somministrazione di 30 microgrammi ciascuna.
Una buona notizia anche se, fanno notare molti esperti, abbiamo solo un comunicato stampa e nessun dato da analizzare. La strada verso la distribuzione di massa di un vaccino efficacia è ancora lunga, ma certamente questa notizia è molto incoraggiante.
Fonti BioNtech, Pfizer e Medicina Informazioni Italia
Notizie correlate: Preliminary U.S. data
Vaccini Covid-19: serve trasparenza sugli accordi commerciali dalle farmaceutiche
Vaccino Pfizer, nel giorno dell’annuncio il Ceo ha venduto azioni per 5,5 milioni di dollari
 L’amministratore delegato Pfizer Albert Bourla ha intascato circa 5,6 milioni di dollari dopo aver venduto azioni. E’ l’ultimo dirigente che ha raccolto i frutti delle transazioni di azioni privilegiate dopo l’annuncio sui vaccini di alcune aziende farmaceutiche. Bourla ha ceduto più di 130.000 azioni lunedì, secondo un deposito presso la US Securities and Exchange Commission. Anche Sally Susman, vicepresidente esecutivo e chief corporate affairs officer di Pfizer, ha scaricato circa 1,8 milioni di dollari in azioni.
L’amministratore delegato Pfizer Albert Bourla ha intascato circa 5,6 milioni di dollari dopo aver venduto azioni. E’ l’ultimo dirigente che ha raccolto i frutti delle transazioni di azioni privilegiate dopo l’annuncio sui vaccini di alcune aziende farmaceutiche. Bourla ha ceduto più di 130.000 azioni lunedì, secondo un deposito presso la US Securities and Exchange Commission. Anche Sally Susman, vicepresidente esecutivo e chief corporate affairs officer di Pfizer, ha scaricato circa 1,8 milioni di dollari in azioni.
Le azioni della Pfizer sono aumentate quel giorno dopo un rapporto sui risultati del suo vaccino sperimentale con il partner BioNTech SE. Anthony Fauci, il massimo specialista in malattie infettive degli Stati Uniti, ha descritto i risultati come “straordinari” e le autorità di regolamentazione su entrambe le sponde dell Atlantico potrebbero autorizzare il vaccino per l’uso di emergenza imminente. (Bloomberg 11 novembre 2020).
Albert Bourla ha assunto ufficialmente la carica di CEO di Pfizer nel 2019. La sua retribuzione totale è aumentata dell’82% rispetto all’anno precedente, quando era direttore operativo di Big Pharma, e ha raggiunto $ 17,9 milioni. La promozione al posto di lavoro principale di Pfizer non è stato l’unico fattore che ha aumentato la retribuzione di Bourla nel 2019, tuttavia. In effetti, il produttore di farmaci ha raggiunto tutti e tre gli obiettivi finanziari utilizzati per valutare il bonus in denaro di un dirigente. Per il 2019, Bourla ha incassato $ 3,63 milioni in premi di incentivi annuali totali sulla scia della forte performance aziendale della società, secondo un deposito titoli (PDF). (Fierce Pharma)
Interrogativi aperti
Quello che manca, dicono Topol e altri scienziati, sono i dettagli sulla natura delle infezioni da cui il vaccino può proteggere, se si tratta per lo più di casi lievi di COVID-19 o è compreso anche un numero significativo di casi moderati e gravi. “Vorrei sapere lo spettro di malattia che previene il vaccino “, dice Paul Offit, vaccinologo dell’Università della Pennsylvania ,che fa parte di un comitato consultivo dell’FDA istituito per valutare il vaccino il mese prossimo. “Ci piacerebbe vedere almeno una manciata di casi di malattia grave nel gruppo placebo”, aggiunge, perché suggerirebbe che il vaccino ha il potenziale per prevenirli.
Inoltre, non è chiaro se il vaccino può impedire alle persone asintomatiche o con sintomi molto lievi di COVID-19 di diffondere il coronavirus. Un vaccino che blocca la trasmissione potrebbe accelerare la fine della pandemia. Ma sarà difficile determinare se il vaccino Pfizer, o altri in fase avanzata di sperimentazione, siano in grado raggiungere questo obiettivo, dice Krammer, perché comporterebbe test di routine ai soggetti sperimentali. “Non si può fare con 45.000 persone”, dice.
Un altro dettaglio che manca è il funzionamento del vaccino in gruppi diversi di soggetti sperimentali. “Non sappiamo ancora se funziona nella popolazione che ne ha più bisogno, cioè quella più anziana”, dice Krammer. A causa del piccolo numero di casi che maturerà prima di terminare, è improbabile che la sperimentazione Pfizer determini in modo definitivo l’efficacia del vaccino in sottogruppi come gli over 65 o gli afroamericani, dice Offit. Ma aggiunge che se lo studio ha arruolato un numero sufficiente di partecipanti di tali gruppi, potrebbe essere possibile generalizzare la probabile efficacia del vaccino in quei gruppi a partire dalla sua efficacia complessiva. Nel comunicato stampa, Pfizer e bioNtech hanno riferito che il 42 per centodei partecipanti aveva “caratteristiche razziali ed etniche diversificate”.
Un’immunità duratura?
Una domanda chiave senza risposta è quanto durerà l’efficacia del vaccino. In base a quando è iniziato lo studio e ai dati pubblicati in precedenza sulle risposte immunitarie nelle prime fasi della sperimentazione, molti partecipanti probabilmente hanno ancora alti livelli di anticorpi protettivi nel sangue, dice Rafi Ahmed, immunologo della Emory University di Atlanta, in Georgia. “Per me, la domanda principale è: cosa succede sei mesi dopo, o anche tre mesi dopo”, dice.
Una risposta sarà possibile se la sperimentazione continuerà ancora per diversi mesi, dice Ahmed. Le risposte potrebbero anche venire dall’analisi delle reazioni immunitarie dei soggetti che hanno partecipato alle prime fasi di sperimentazione del vaccino Pfizer, alcuni dei quali potrebbero aver ricevuto il vaccino fino a 6 mesi fa. E anche se si sa poco sull’efficacia a lungo termine del vaccino, è improbabile che questo possa limitarne l’uso, dice Ahmed. “Non credo che potremo dire: ‘Beh, prenderò soltanto un vaccino che mi proteggr per cinque anni’. Voglio dire, sarebbe una pazzia”.
I risultati sono importanti anche per altri sviluppatori del vaccino COVID-19, come il vaccino in fase di sviluppo da parte di Moderna, un’azienda biotecnologica di Cambridge, Massachusetts, e dall’US National Institute of Allergy and Infectious Disease, a Bethesda, Maryland, che sfrutta anch’esso l’mRNA, dice Krammer. “Mi aspetto che le azioni di Moderna oggi salgano”.
Shane Crotty, vaccinologo del La Jolla Institute for Immunology, in California, pensa che Moderna non sia l’unico sviluppatore che dovrebbe festeggiare per i risultati preliminari di Pfizer. Vari altri candidati vaccini hanno innescato risposte immunitarie simili a quelle suscitate dal vaccino Pfizer nelle prime fasi di sperimentazione, quindi dovrebbero funzionare bene.
Una cosa sul vaccino Pfizer è certa: gli enti regolatori valuteranno presto se è pronto per essere somministrato alla popolazione. L’azienda ha detto che chiederà alla FDA un’autorizzazione per l’uso d’emergenza verso la terza settimana di novembre, quando i partecipanti saranno stati seguiti per una media di due mesi – un requisito di sicurezza della FDA per i vaccini COVID-19.
E anche se i ricercatori vogliono vedere i dati alla base della sperimentazione del vaccino Pfizer, sono disposti ad accettare le cautele che li accompagnano. “In questo momento abbiamo bisogno di un vaccino che funzioni”, dice Krammer, anche se funziona solo per pochi mesi o non interrompe il contagio. “È ciò che ci serve per arrivare a metà della strada verso la normalità”.
(L’originale di questo articolo è stato pubblicato su “Nature” il 9 novembre 2020. Traduzione ed editing a cura di Le Scienze. Riproduzione autorizzata, tutti i diritti riservati.)
Notizie correlate: Pfizer: una multinacional farmacéutica corrupta y con un historial de numerosos errores





