
Sono figli di immigrati turchi arrivati in Germania negli anni Sessanta gli immuno-oncologi cofondatori di  BioNTech, l’azienda che ha sviluppato per Pfizer il vaccino anti Covid: Ugur Sahin, 56 anni, nato ad Alessandretta (Turchia), e Özlem Türeci, 54 anni, nata a Lastrup (Germania). Sposati nel 2002, grazie alle azioni di BioNTech sono le prime persone di origine turca a entrare nella lista dei cento tedeschi più ricchi, con un valore personale stimato da Bloomberg Billionaires Index in 10,6 miliardi di dollari.
BioNTech, l’azienda che ha sviluppato per Pfizer il vaccino anti Covid: Ugur Sahin, 56 anni, nato ad Alessandretta (Turchia), e Özlem Türeci, 54 anni, nata a Lastrup (Germania). Sposati nel 2002, grazie alle azioni di BioNTech sono le prime persone di origine turca a entrare nella lista dei cento tedeschi più ricchi, con un valore personale stimato da Bloomberg Billionaires Index in 10,6 miliardi di dollari.
Ugur Sahin e Ozlem Tureci, i coniugi immuni-oncologi cofondatori di BioNTech nel 2008, l’azienda che ha sviluppato per Pfizer il vaccino anti-Covid, si sono ufficialmente espressi in una dichiarazione, come riportato da Repubblica: “Abbiamo 15 vaccini anticancro in fase di test clinico, il più avanzato è quello contro il melanoma. Prevediamo nei prossimi 5 anni di portarne qualcuno sul mercato e di portare altri nuovi vaccini in fase avanzata di sviluppo clinico”.
L’avventura scientifica di Sahin e Tureci è iniziata già dagli anni Novanta alla ricerca di un modo per aiutare il sistema immunitario a combattere i tumori attraverso l’RNA messaggero. Si tratta della stessa tecnologia alla base del vaccino anticoronavirus e della ricerca per combattere tutta una serie di malattie (dai melanomi alle sindromi autoimmuni e a quelle allergiche). La coppia di scienziati, sposati dal 2002, lo racconta nel libro Il vaccino che ha cambiato il mondo (Mondadori), scritto con il giornalista Joe Miller.
A Repubblica Ugur Sahin chiarisce: ″È la più antica forma di programmazione costruita dalla natura, perché passa alle cellule le istruzioni per produrre le proteine. Abbiamo capito subito l’enorme potenziale che c’era nel fornire informazioni – a nostro piacimento – direttamente alle cellule immunitarie, codificandole nello mRna. Per poi lasciare che il sistema immunitario faccia quello che sa fare meglio: proteggere il nostro corpo dalle minacce”.
 Tureci aggiunge che la pandemia è stata solo il battesimo del fuoco per l’impiego della tecnologia mRna e afferma che “i prossimi cinque-dieci anni potrebbero portare a un cambiamento di paradigma in molti dei vaccini esistenti”. L’Rna messaggero, dicono i genitori del vaccino anticoronavirus, potrebbe aiutare a combattere tutti i tipi di tumore solido (dal melanoma al carcinoma del colon-retto).
Tureci aggiunge che la pandemia è stata solo il battesimo del fuoco per l’impiego della tecnologia mRna e afferma che “i prossimi cinque-dieci anni potrebbero portare a un cambiamento di paradigma in molti dei vaccini esistenti”. L’Rna messaggero, dicono i genitori del vaccino anticoronavirus, potrebbe aiutare a combattere tutti i tipi di tumore solido (dal melanoma al carcinoma del colon-retto).
Non solo i tumori, l’mRna potrebbe infatti combattere altre malattie, dalla malaria alla tubercolosi, e in prospettiva l’HIV. Ecco cosa aggiungono a questo proposito Sahin e Tureci:
“Nel 2022 contiamo di iniziare i test clinici per i vaccini contro la malaria e la tubercolosi. E andremo avanti con il nostro programma di un vaccino contro l’Hiv. Ma non finisce qui: l’mRna ci permette di riprogrammare il sistema immunitario non solo per stimolarlo, ma anche per calmarlo: e questo sarà prezioso per la cura delle malattie autoimmuni – dove i danni sono fatti da un sistema immunitario iper-reattivo – e nella medicina rigenerativa”.
La ricerca, evidentemente con anni di prezioso e futuristico lavoro alle spalle, è più avanti di quanto lontanamente pensabile. Sahin e Tureci adesso lo dichiarano ufficialmente ed aggiungono che entro 5/10 anni cambierà’ l’intero paradigma di tutti i vaccini esistenti.
Notizie correlate: Vaccini contro il cancro entro cinque anni, i coniugi Biontech sicuri
Come viene utilizzato l’mRNA nei tumori
Il corpo umano si serve di “intermediari”, che hanno il compito di processare l’antigene (molecola in grado di essere riconosciuta dal sistema immunitario come estranea o potenzialmente pericolosa) e di presentarlo negli organi linfoidi secondari, dove sono concentrati la maggior parte dei linfociti T naïve (linfociti T non ancora differenziati). Le cellule che catturano gli antigeni dal patogeno sono dette cellule presentanti l’antigene (APC, Antigen Presenting Cell): cellule dendritiche, macrofagi e linfociti B.
I linfociti T sono specializzati nel riconoscimento di microrganismi intracellulari, cellule tumorali e organismi patogeni solo se esso viene “presentato” sulla superficie di una cellula APC. L’antigene si trova sulla membrana cellulare delle APC, complessato con le proteine del complesso maggiore di istocompatibilità (MHC), e non quindi nella sua forma solubile. I linfociti T possiedono un sistema di recettori, TCR/CD4 (helper)-CD8 (citotossici), tramite i quali riescono a riconoscere il peptide antigenico, presente in un complesso con le proteine dell’MHC.
I linfociti B, invece, sono in grado di riconoscere gli antigeni direttamente (fungendo, dunque da APC) sulle membrane della cellula ospite, e producono recettori dell’antigene anche in forma solubile (anticorpi)
La principale funzione dei linfociti B è quella di produrre anticorpi contro uno specifico antigene svolgendo anche il ruolo di APC (cellula presentante l’antigene) ed eventualmente evolversi in linfociti B memoria dopo l’attivazione dovuta all’interazione con un antigene.
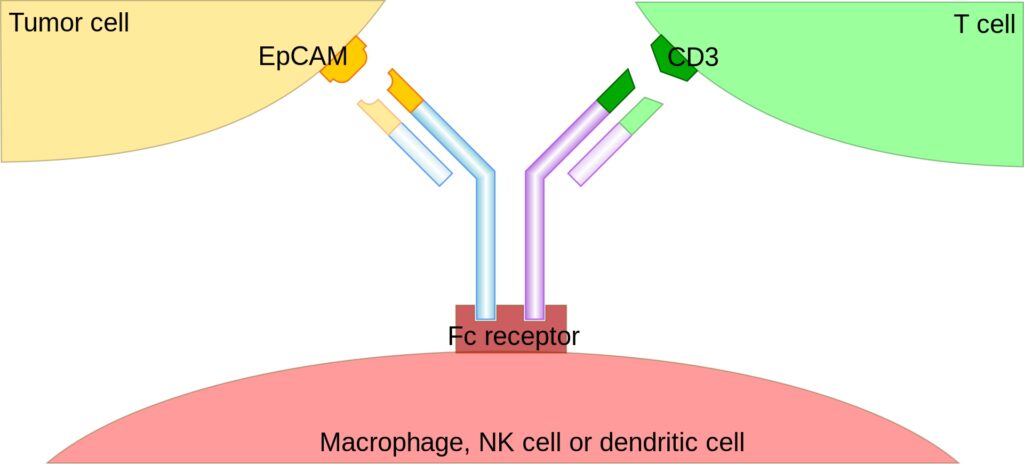 Un anticorpo monoclonale bispecifico o BsMAb o BsAb è una proteina artificiale che è composta di frammenti di due diversi anticorpi monoclonali; questo le permette di legarsi contemporaneamente a due diversi tipi di antigene. Solitamente nell’immunoterapia dei tumori con i normali anticorpi monoclonali non vengono attivati i linfociti T. Un anticorpo monoclonale bispecifico contemporaneamente si lega ad un citotossico cellulare (usando un recettore come il CD3 di un linfocita T) e all’obiettivo terapeutico: le cellule tumorali da distruggere.
Un anticorpo monoclonale bispecifico o BsMAb o BsAb è una proteina artificiale che è composta di frammenti di due diversi anticorpi monoclonali; questo le permette di legarsi contemporaneamente a due diversi tipi di antigene. Solitamente nell’immunoterapia dei tumori con i normali anticorpi monoclonali non vengono attivati i linfociti T. Un anticorpo monoclonale bispecifico contemporaneamente si lega ad un citotossico cellulare (usando un recettore come il CD3 di un linfocita T) e all’obiettivo terapeutico: le cellule tumorali da distruggere.
Sono state sviluppate diverse modalità bispecifiche, ma la loro utilità è limitata a causa di problemi di stabilità e complessità di fabbricazione.
Il potenziale degli anticorpi bispecifici che coinvolgono le cellule T è ostacolato dalle difficoltà di produzione e dalla breve emivita sierica. Ricercatori hanno aggirato queste limitazioni trattando i topi con mRNA trascritto in vitro farmacologicamente ottimizzato e con nucleosidi modificati che codificano per l’anticorpo. Si è quindi ottenuto una sintesi endogena prolungata dell’anticorpo, che ha eliminato i tumori avanzati con la stessa efficacia del corrispondente anticorpo bispecifico purificato. Poiché la produzione di mRNA farmaceutico è veloce, questo approccio potrebbe accelerare lo sviluppo clinico di nuovi anticorpi bispecifici.
Le cellule T dirette contro i neoepitopi mutanti guidano l’immunità al cancro. Per epitopo si intende quella piccola parte di antigene che lega l’anticorpo specifico. La singola molecola di antigene può contenere diversi epitopi riconosciuti da anticorpi differenti. I neoepitopi sono pezzi di proteine alterate nella cellula tumorale che il sistema immunitario può potenzialmente bersagliare.
 Tuttavia, il riconoscimento immunitario spontaneo delle mutazioni è inefficiente. Si è recentemente introdotto il concetto di vaccini mutanomici individualizzati e implementato un approccio poli-neo-epitopo basato sull’RNA per mobilitare l’immunità contro uno spettro di mutazioni del cancro. Qui riportiamo la prima applicazione nell’uomo di questo concetto nel melanoma. Si è impostato un processo che comprende l’identificazione completa delle singole mutazioni, la previsione computazionale di neo-epitopi e la progettazione e produzione di un vaccino unico per ogni paziente.
Tuttavia, il riconoscimento immunitario spontaneo delle mutazioni è inefficiente. Si è recentemente introdotto il concetto di vaccini mutanomici individualizzati e implementato un approccio poli-neo-epitopo basato sull’RNA per mobilitare l’immunità contro uno spettro di mutazioni del cancro. Qui riportiamo la prima applicazione nell’uomo di questo concetto nel melanoma. Si è impostato un processo che comprende l’identificazione completa delle singole mutazioni, la previsione computazionale di neo-epitopi e la progettazione e produzione di un vaccino unico per ogni paziente.
Tutti i pazienti hanno sviluppato risposte delle cellule T contro più neoepitopi vaccinali fino a percentuali elevate a una cifra. L’infiltrazione delle cellule T indotta dal vaccino e l’uccisione specifica del neoepitopo delle cellule tumorali autologhe sono state mostrate nelle metastasi resecate post-vaccinazione da due pazienti. Il tasso cumulativo di eventi metastatici è stato ridotto in modo altamente significativo dopo l’inizio della vaccinazione, determinando una sopravvivenza libera da progressione sostenuta. Due dei cinque pazienti con malattia metastatica hanno manifestato risposte obiettive correlate al vaccino. Uno di questi pazienti ha avuto una recidiva tardiva a causa della crescita di cellule di melanoma carenti di β -microglobulina come meccanismo di resistenza acquisita. Un terzo paziente ha sviluppato una risposta completa alla vaccinazione in combinazione con la terapia con blocco del PD-1 (proteine programmata di morte che funzionano come “sistema di frenatura„ all’interno del sistema immunitario). Lo studio dimostra che le singole mutazioni possono essere sfruttate, aprendo così la strada all’immunoterapia personalizzata per i pazienti con cancro.

Nota:
il DNA contiene l’informazione genetica, le proteine eseguono le funzioni biologiche mentre l’RNA agisce da ponte nella trasmissione dell’informazione genetica. Solo circa il 2% (20 000 geni) del DNA è tradotto in proteine, il restante 98% generato nelle cellule umane è RNA non codificante (ncRNA).
I medicinali a RNA sono farmaci a base di acido ribonucleico (RNA). I tipi principali sono quelli basati su RNA messaggero (mRNA), RNA antisenso (asRNA), RNA interference (RNAi) e aptameri dell’RNA.
La terapia basata sull’mRNA è l’unico tipo che si basa sull’attivazione della sintesi proteica all’interno delle cellule; nel 2020 sono stati sviluppati vaccini a mRNA per combattere la pandemia da SARS-CoV-2. Nella denominazione comune internazionale i farmaci a mRNA assumono la desinenza -meran.
L’RNA antisenso è complementare all’mRNA e viene utilizzato per inattivare un mRNA, impedendo che l’mRNA venga utilizzato per la traduzione delle proteine. Rappresenta uno specifico tipo di ncRNA impiegato nella regolazione genetica a vari livelli nella cellula, come durante la trascrizione degli mRNA e la traduzione proteica.
I sistemi basati su RNAi utilizzano un meccanismo simile, e implicano l’uso di short interfering RNA (siRNA) e microRNA (miRNA) per prevenire la traduzione, in sostanza è un meccanismo mediante il quale alcuni frammenti di RNA sono in grado di interferire (e spegnere) l’espressione genica. La RNAi sta avendo un numero crescente di applicazioni nel campo dell’ingegneria genetica. Il dsRNA (RNA a doppio filamento) che avvia la RNAi può essere utilizzato come farmaco. La prima applicazione in questo senso a raggiungere i trial clinici è stata quella per il trattamento per la degenerazione maculare.
Gli aptameri di RNA sono molecole di RNA corte, a filamento singolo, prodotte tramite evoluzione diretta per legarsi a una varietà di bersagli biomolecolari (molecola o proteina) con elevata affinità, influenzando così la loro normale attività in vivo. Fino al 2011, tutti gli aptameri conosciuti erano formati da RNA o DNA, dato che solamente sequenze di DNA o RNA potevano essere amplificate con tecniche note di biologia molecolare. Nel 2011, lo sviluppo di enzimi che permettono di copiare sequenze di acidi nucleici artificiali hanno permesso lo sviluppo di aptameri costituiti da acido treonucleico (TNA) e HNA (hexose nucleic acid).
Per arrivare ai vaccini a RNA messaggero ci sono voluti vent’anni di ricerca finalizzati però a un altro importantissimo obiettivo, la lotta contro il cancro.
Il sogno degli scienziati era ottenere un vaccino terapeutico contro il cancro che fino a oggi non ha avuto successo, ma ha prodotto un risultato fondamentale nella lotta al Coronavirus.
Abbiamo già due vaccini preventivi contro il cancro: quello anti-epatite B, che previene non solo la malattia infettiva ma anche il tumore del fegato, ovvero una delle conseguenze dell’epatite cronica; e quello che protegge dall’infezione del papilloma virus umano (vaccino anti-HPV) che causa i tumori della cervice uterina e altri tipi di tumore (testa e collo) che colpiscono donne e uomini. Gli scienziati puntano a produrre vaccini terapeutici con la tecnica dell’RNA messaggero per i paziente malati di tumore.
AstraZeneca, insieme alla sua divisione R&S globale nel settore biotecnologico, MedImmune, e Moderna Therapeutics, hanno annunciato l’avvio di una collaborazione per scoprire, sviluppare e commercializzare insieme nuove terapie basate sull’RNA messaggero (mRNA) candidate per il trattamento di una serie di tumori. La collaborazione si inserisce, ampliandolo, nell’accordo annunciato dalle società nel 2013 per sviluppare le mRNA Therapeutics™ per il trattamento delle malattie cardiovascolari, metaboliche e renali, nonché per terapie oncologiche mirate.
Moderna sta lavorando anche a vaccini a mRNA capaci di riconoscere mutazioni in un gene (KRAS) implicato nel 20% dei tumori umani, mentre CureVac, azienda europea di biotecnologie impegnata nei test di un vaccino anti-covid, sta conducendo sperimentazioni per un vaccino contro un tipo di tumore ai polmoni.
Una tecnologia simile a quella dei vaccini a mRNA potrebbe rivelarsi promettente contro la malaria. Per debellare l’infezione che uccide 400.000 persone all’anno, la DARPA (l’agenzia della Difesa USA che sviluppa tecnologie per uso militare) e Pfizer stanno pensando a un vaccino che sfrutti l’RNA autoamplificante (self-ampling RNA o saRNA). Il funzionamento è simile, ma il saRNA produce multiple copie di sé nella cellula, come in un ossessivo copia-incolla, prima di spingerla a produrre proteine. Basta quindi una minuscola quantità di vaccino per ottenere una robusta risposta immunitaria: è sufficiente fornire alle cellule l’input iniziale. In questo caso non sarebbe tanto la dose di vaccino ma la vaccinazione in sé, a prevenire l’infezione.





