“Superare problematica: ci sono famiglie e bambini in attesa di una terapia indispensabile e a loro negata”. Non è certo il vicepresidente dell’Assogenerici la voce “obiettiva” che deve rilasciare dichiarazioni visto che vi è un evidente conflitto di interessi.
 Foggia – ”GENTILE direttore di Statoquotidiano.it; le invio una lettera esplicativa sui farmaci biologici e biosimilari che la Regione Puglia impone e che l’ufficio Farmaceutico della ASL FG rifiuta di somministrare. Problema peraltro che riguarda tutta la Regione e non solo la Capitanata”. (A cura del Dott. Antonio Longo. Direttore U.O. DI PEDIATRIA azienda ospedaliero-universitaria di Foggia; Foggia, 27 novembre 2014).”
Foggia – ”GENTILE direttore di Statoquotidiano.it; le invio una lettera esplicativa sui farmaci biologici e biosimilari che la Regione Puglia impone e che l’ufficio Farmaceutico della ASL FG rifiuta di somministrare. Problema peraltro che riguarda tutta la Regione e non solo la Capitanata”. (A cura del Dott. Antonio Longo. Direttore U.O. DI PEDIATRIA azienda ospedaliero-universitaria di Foggia; Foggia, 27 novembre 2014).”
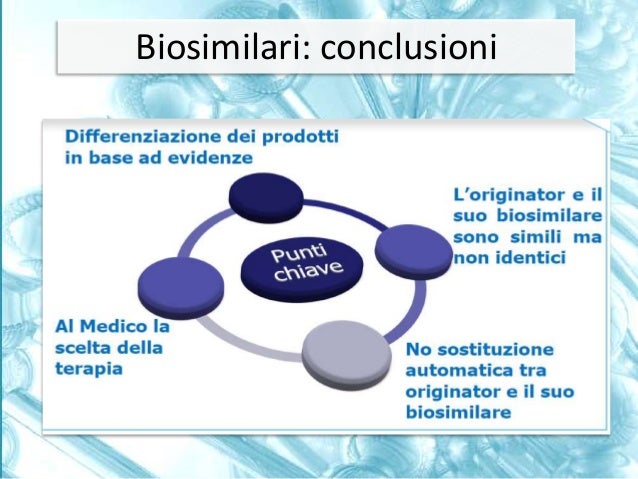
THE TEXT. ”La delibera della regione Puglia “impone” l’uso del Gh biosimilare per il suo basso costo,però da facoltà al medico di prescrivere il biologico giustificandone l’uso,tanto da ricordargli l’eventuale danno erariale. Se un evento avverso qualsiasi dovesse ricorrere sarebbe il medico e non la regione a risponderne visto che il medico aveva facoltà diprescription. Quanto basta per creare una attenta riflessione clinica e un atteggiamento di tutela medico legale.Inutile ricordare quanto i medici siano sottoposti a procedimenti giudiziari inappropiati e costosi,vorrei rammentare che il tribunale di Milano con una sentenza “Monstre” ha condannato il ministero della salute per un vaccino somministrato,immaginate se il medico vaccinatore avesse avuto facoltà di scelta,sarebbe stato condannato lui e non l’istituzione. Detto questo per il biosimilare mi sembra si stia esagerando con le dichiarazioni, e’ simile e non eguale ,e questo lo sostiene anche l’Aifa sottolineando la non equivalenza biologica nel caso di passaggio da biologico a biosimilare che ha una sequenza ANTIGENICA fino al 20% diversa.
Non è certo il vicepresidente dell’Assogenerici la voce “obiettiva” che deve rilasciare dichiarazioni visto che vi è un evidente conflitto di interessi. E ‘ vero ci sono in Europa 36.000 bambini che sono in cura con il biosimilare, con i biologici i numeri sono 10 volte di più e con 20 anni di esperienza contro i sei anni del biosimilare, la fiducia del medico non può che rivolgersi sui farmaci con più esperienza clinica, con costo minore e eguale equivalenza biologica,se poi i farmacisti credono di sostituirsi al giudizio del medico facciano pure ma si assumano insieme alla Regione le dovute responsabilità.
Questa tutela nei confronti del bambino e dell’operato del medico sono frutto dell’esperienza clinica e storica del medico, non si può non ricordare che in questi anni sotto la spinta delle multinazionali del farmaco sono stati immessi sul mercato farmaci poi ritirati dopo alcuni anni, per effetti collaterali gravi e mortali, in questi casi le istituzioni e non il medico sono state chiamate a rispondere per le loro scelte .
Invito i protagonisti istituzionali di questa triste “querelle” a risolvere con urgenza questa problematica ricordando che ci sono famiglie e bambini in attesa di una terapia indispensabile e a loro negata”.
(A cura del Dott.Antonio Longo. Direttore U.O. DI PEDIATRIA azienda ospedaliero-universitaria di Foggia; Foggia, 27 novembre 2014).
Related news: Puglia Region replaces organic with biosimilar. Patients protest. Asl: supply never interrupted
Biosimilari, l’Ema ha pubblcato la revisione delle linee guida
Venerdì, 28 Novembre 2014 – Doctor33
L’Agenzia europea dei medicinali ha emesso l’atteso aggiornamento delle linee guida in materia di biosimilari, con l’obiettivo di facilitare lo sviluppo globale di questi medicinali. Le nuove linee guida, che fanno seguito a quelle emesse nel settembre 2005, intendono chiarire quello che viene denominato “approccio biosimilare” e spiegano come le aziende possono stabilire la biosimilarità dei loro prodotti con i biologici originali approvati dall’Ema. Il principale cambiamento introdotto dal nuovo documento è la possibilità per gli sviluppatori di farmaci di utilizzare un comparatore autorizzato al di fuori dell’Area economica europea (Eea) nel corso della sperimentazione clinica per lo sviluppo di un farmaco biosimilare, in modo tale da facilitarne lo sviluppo globale ed evitare inutili ripetizioni di studi clinici. Oltre a questa novità, le linee guida aggiornate chiariscono altri aspetti fondamentali, alla luce dell’esperienza acquisita dal loro primo rilascio, tra cui i principi di biosimilarità, compresi gli aspetti di sicurezza e di efficacia, la terminologia per i biosimilari, i requisiti relativi alla posologia, alla via di somministrazione e alla formulazione. Il problema basilare affrontato da enti regolatori e industria è che i biologici sono del tutto differenti rispetto ai farmaci chimici ed è praticamente impossibile duplicarli in modo preciso. La sfida è dunque quella di assicurare che piccole differenze tra i prodotti non diano problemi di sicurezza o di efficacia per i pazienti.
L’Ema dichiara che ogni biosimilare verrà valutato in base ai suoi meriti. Per esempio, l’ente regolatore intende considerare i metodi analitici, i modelli utilizzati per comparare i risultati clinici e i processi di produzione adottati per la creazione e validazione del prodotto biosimilare. I medicinali dovranno anche essere somministrati allo stesso modo, per esempio per iniezione, anche se l’Ema dichiara che piccole variazioni in termini di forza, formato, formulazione e utilizzo degli eccipienti sarà accettato, purché sia giustificato e non comprometta la sicurezza.
Renato Torlaschi