It is up to AIFA and the Technical-Scientific Commission to define innovation, evaluate it and confer the status of innovative medicinal product which presupposes the evaluation of three basic elements: therapeutic need, added therapeutic value and robustness of the scientific tests submitted by the company to support of the request for innovation. AIFA has established that the evaluation of this attribute must take place through a single model for all drugs, but allows, if necessary, the use 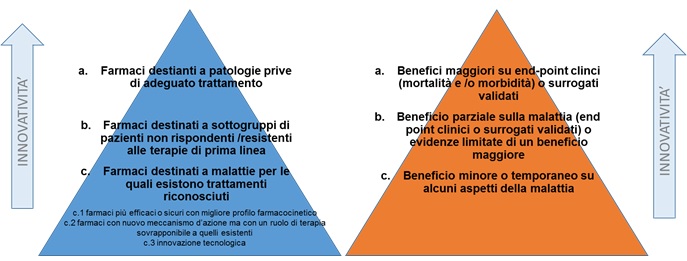
Criteria for the classification of innovative drugs and innovative oncological drugs
With the determines no. 1535/2017 l’AIFA ha individuato i criteri per la classificazione dei farmaci innovativi e dei farmaci oncologici innovativi ai sensi dell’articolo 1, comma 402 della legge 11 dicembre 2016, n. 232.
PDF Allegato 2 – Modulo per la richiesta del riconoscimento dell’innovatività [0.39 Mb] >
L’Agenzia rende disponibili i report di valutazione per il riconoscimento dell’innovatività, per indicazione terapeutica,in ottemperanza a quanto disposto dalla Determina AIFA n.1535/2017.
Report di valutazione dell’innovatività per indicazione terapeutica (13/09/2019) [0.02 Mb] >
L’Aifa pubblica l’elenco aggiornato dei medicinali che, a giudizio della Commissione Tecnico Scientifica, possiedono il requisito della innovatività terapeutica/importante e/o innovatività terapeutica potenziale/condizionata, ai sensi dell’articolo 10, comma 2 della Legge n. 189/2012, come definito dall’art.1 comma 1 dell’accordo Stato Regioni del 18 novembre 2010 (Rep.Atti n.197/CSR).
PDF List of innovative drugs (Law 189/2012) (10/09/2019) [0.24 Mb] >
