
L’AIFA aggiorna l’elenco dei medicinali che, a giudizio della Commissione Tecnico Scientifica (CTS), possiedono il requisito di innovatività terapeutica piena o condizionata.
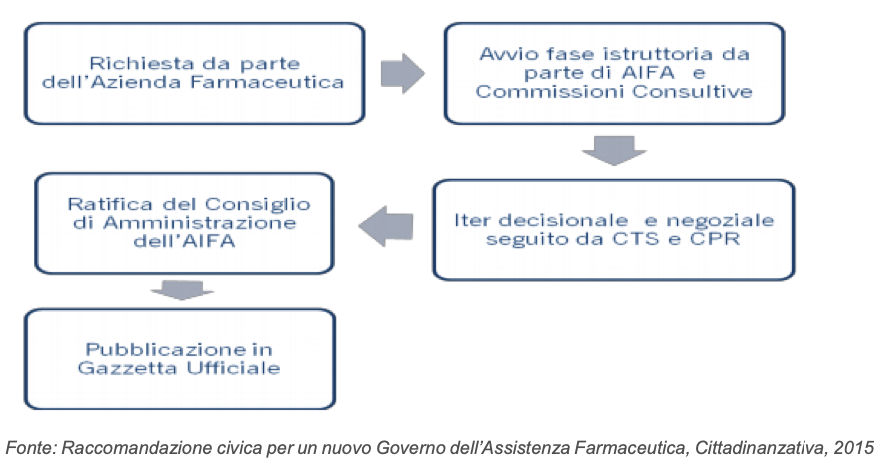 Contestualmente vengono resi disponibili i report di valutazione per il riconoscimento dell’innovatività, per ciascuna indicazione terapeutica.
Contestualmente vengono resi disponibili i report di valutazione per il riconoscimento dell’innovatività, per ciascuna indicazione terapeutica.
L’aggiornamento include i seguenti farmaci:
1. BLINCYTO (blinatumomab) indicato in monoterapia per il trattamento di pazienti pediatrici di età pari o superiore a 1 anno con LLA da precursori delle cellule B in prima recidiva ad alto rischio, positiva per CD19, negativa per il cromosoma Philadelphia, come parte della terapia di consolidamento.
2. KAFTRIO (ivacaftor/tezacaftor/elexacaftor) indicato in un regime di associazione con ivacaftor per il trattamento della fibrosi cistica (FC) in pazienti di età compresa tra 6 e < 12 anni che sono omozigoti per la mutazione F508del nel gene per il regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) (genotipo F/F) o eterozigoti con una mutazione a funzione minima (genotipo F/MF).
3. KALYDECO (ivacaftor) indicato in un regime di associazione con ivacaftor/tezacaftor/elexacaftor per il trattamento della fibrosi cistica (FC) in pazienti di età compresa tra 6 e < 12 anni che sono omozigoti per la mutazione F508del nel gene per il regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) (genotipo F/F) o eterozigoti con una mutazione a funzione minima (genotipo F/MF).
4. KEYTRUDA (pembrolizumab) indicato in monoterapia per il trattamento di pazienti adulti e pediatrici di età pari o superiore a 3 anni affetti da linfoma di Hodgkin classico recidivato o refrattario (r/r cHL) che abbiano fallito il trattamento con trapianto autologo di cellule staminali (ASCT) o a seguito di almeno due precedenti terapie quando ASCT non è un’opzione di trattamento.
5. OPDIVO (nivolumab) indicato in associazione ad ipilimumab per il trattamento in prima linea di pazienti adulti con mesotelioma maligno della pleura non resecabile con istologia non epiteliode.
6. SOLIRIS (eculizumab) è indicato nel trattamento di seconda linea, dopo rituximab, del disturbo dello spettro della neuromielite ottica (NMOSD) in pazienti adulti positivi agli anticorpi anti-acquaporina 4 (AQP4) con storia clinica di almeno una recidiva negli ultimi 12 mesi e un punteggio alla scala EDSS (Expanded Disability Status Scale) ≤ 7.
7. SOLIRIS (eculizumab) indicato nel trattamento di adulti affetti da Miastenia gravis generalizzata refrattaria (MGg) in pazienti positivi agli anticorpi anti recettore dell’acetilcolina (AChR).
8. TAGRISSO (osimertinib) indicato in monoterapia per il trattamento adiuvante dopo resezione completa del tumore in pazienti adulti con carcinoma polmonare non a piccole cellule (NSCLC) in stadio IB-IIIA il cui tumore presenta delezioni dell’esone 19 o mutazione sostitutiva dell’esone 21 (L858R) del recettore per il fattore di  crescita epidermico (EGFR).
crescita epidermico (EGFR).
9. VOXZOGO (vosoritide) indicato nel trattamento dell’acondroplasia in pazienti di età compresa tra i cinque e i quattordici anni al momento dell’inizio della terapia e le cui epifisi non siano chiuse. La diagnosi di acondroplasia deve essere confermata mediante opportuna analisi genetica.
10. YERVOY (ipilimumab) indicato in associazione a nivolumab per il trattamento in prima linea di pazienti adulti con mesotelioma maligno della pleura non resecabile con istologia non epiteliode.
L’elenco rappresenta i prodotti innovativi che devono essere resi immediatamente disponibili agli assistiti, anche senza il formale inserimento nei prontuari terapeutici ospedalieri regionali. Il riferimento all’inserimento in elenco è pubblicato in Gazzetta Ufficiale per ogni singola specialità in relazione all’indicazione in regime di rimborso SSN. Tale elenco include anche il dettaglio dei prodotti che hanno accesso al fondo farmaci innovativi oncologici e non oncologici (art. 1, commi 402, 403 e 404, della legge 11 dicembre 2016, n. 232 e ss.mm.ii).
Sono anche pubblicati i seguenti report relativi ai medicinali che hanno ottenuto esito negativo nella valutazione ai fini dell’innovatività:
1. ENSPRYNG (satralizumab) indicato negli adolescenti dai 12 ai <18 anni di età in monoterapia o in associazione a terapia immunosoppressiva (TIS) per il trattamento dei disturbi dello spettro della neuromielite ottica (NMOSD), in presenza di sieropositività per le IgG anti-acquaporina-4 (AQP4-IgG) (come da indicazione autorizzata) e con punteggio di EDSS basale ≤6.5. Nei pazienti che iniziano il trattamento in età adulta è indicato come trattamento di seconda linea dopo rituximab, o in caso di controindicazioni all’utilizzo di rituximab, in monoterapia o in associazione a terapia immunosoppressiva per il trattamento dei disturbi dello spettro della neuromielite ottica (NMOSD) in presenza di sieropositività per le IgG anti-acquaporina 4 (AQP4), storia clinica di almeno una recidiva negli ultimi 12 mesi e un punteggio alla scala EDSS (Expanded Disability Status Scale) ≤ 6.5.
2. JEMPERLI (dostarlimab) indicato come monoterapia per il trattamento di pazienti adulte affette da carcinoma endometriale avanzato o ricorrente, con deficit del sistema di Mismatch Repair (dMMR)/elevata instabilità dei microsatelliti (MSI-H), progredito durante o dopo un precedente trattamento con un regime a base di platino.
3. KAFTRIO (ivacaftor/tezacaftor/elexacaftor) indicato in un regime di associazione con ivacaftor per il trattamento della fibrosi cistica (FC) in pazienti di età compresa tra 6 e < 12 anni che sono eterozigoti per la mutazione F508del nel gene per il regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) (genotipi F/RF, F/G, F/non classificata, F/non identificata).
4. KALYDECO (ivacaftor) indicato in un regime di associazione con ivacaftor/tezacaftor/elexacaftor per il trattamento della fibrosi cistica (FC) in pazienti di età compresa tra 6 e < 12 anni che sono eterozigoti per la mutazione F508del nel gene per il regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) (genotipi F/RF, F/G, F/non classificata, F/non identificata).
AIFA – Pubblicato il: 03 ottobre 2022
__________________________________
Aifa, ‘3mila prodotti carenti, 500 in più da giugno 2021’
yahoo finanza – 3 ottobre 2022
 “Il numero di carenze” di farmaci “sta aumentando: tra il giugno 2021 e oggi, le Aic (Autorizzazioni all’immissione in commercio) nella lista dei farmaci carenti, che l’Agenzia italiana del farmaco pubblica in trasparenza nel suo sito, sono passate da circa 2.500 a quasi 3.000, con una deriva regolare. Va però sottolineato che invece l’elenco dei farmaci carenti ‘critici’ – quelli per i quali, in assenza di analoghi, Aifa autorizza l’importazione – è rimasto sostanzialmente invariato: la percentuale di ‘critici’ tra i farmaci carenti è scesa dall’11% al 9,5%”. A tracciare il quadro all’Adnkronos Salute è Dominic Di Giorgio, dirigente dell’Area Ispezioni e Certificazioni dell’Agenzia italiana del farmaco Aifa.
“Il numero di carenze” di farmaci “sta aumentando: tra il giugno 2021 e oggi, le Aic (Autorizzazioni all’immissione in commercio) nella lista dei farmaci carenti, che l’Agenzia italiana del farmaco pubblica in trasparenza nel suo sito, sono passate da circa 2.500 a quasi 3.000, con una deriva regolare. Va però sottolineato che invece l’elenco dei farmaci carenti ‘critici’ – quelli per i quali, in assenza di analoghi, Aifa autorizza l’importazione – è rimasto sostanzialmente invariato: la percentuale di ‘critici’ tra i farmaci carenti è scesa dall’11% al 9,5%”. A tracciare il quadro all’Adnkronos Salute è Dominic Di Giorgio, dirigente dell’Area Ispezioni e Certificazioni dell’Agenzia italiana del farmaco Aifa.
L’esperto spiega che dietro le carenze di farmaci c’è un mondo complesso ed eterogeneo. Le cause che portano una spia rossa ad accendersi sono diverse, come diverso è l’impatto delle carenze, a seconda anche del tipo di farmaco interessato dal problema e della presenza sul mercato di analoghi o meno. Approfondendo la crescita osservata nell’ultimo periodo, Di Giorgio spiega che, rimanendo stabili i casi ‘critici’, “questo significa che l’incremento delle carenze riguarda soprattutto aspetti ‘commerciali’, ovvero prodotti, anche di recente autorizzazione, che magari interrompono la commercializzazione per valutazioni economiche, dovendo competere in un mercato dove sono presenti molti equivalenti”. A pesare, analizza Di Giorgio, sono in particolare i costi più alti.
Si pensi a quei prodotti – farmaci che magari scompaiono dal mercato senza troppo rumore – che si trovano sulla soglia della remuneratività. “Una soglia che si è alzata” con l’aumento dei costi, fra crisi energetica, boom dei prezzi del carburante, guerra in Ucraina e difficoltà nel reperire certi materiali. Qui non entra il discorso della salute pubblica, ma, osserva l’esperto, “è un fenomeno reale il fatto che l’aumento dei costi impatta anche sulla farmaceutica e quindi statisticamente capiteranno più casi. E fra questi potrebbe capitare che a soccombere sia anche un farmaco su cui invece c’erano speranze, che serviva”. Per limitare l’impatto degli  extracosti la discussione con le associazioni di categoria e con i produttori è partito già da diversi mesi. “In generale – sottolinea Di Giorgio – noi agiamo anche quando vediamo nubi all’orizzonte. Non lasciamo segnali disattesi. L’aumento dei costi c’è e dobbiamo evitare che in prospettiva possa andare in carenza anche qualche farmaco” in una posizione più cruciale.
extracosti la discussione con le associazioni di categoria e con i produttori è partito già da diversi mesi. “In generale – sottolinea Di Giorgio – noi agiamo anche quando vediamo nubi all’orizzonte. Non lasciamo segnali disattesi. L’aumento dei costi c’è e dobbiamo evitare che in prospettiva possa andare in carenza anche qualche farmaco” in una posizione più cruciale.
Related news: Gimbe. Determina AIFA per la classificazione dei farmaci innovativi: analisi metodologica e monitoraggio dell’applicazione
Analisi Civica della Determina AIFA sui farmaci innovativi





