CAR-T: recettore chimerico dell’antigene, una proteina ibrida sintetica – non esiste cioè in natura – che riconosce il tumore e attiva il linfocita T
Normalmente non parliamo mai in modo specifico di farmaci perché essendo parte in causa ci si potrebbe accusare di conflitto di interessi. Negli ultimi giorni però molti giornali hanno parlato della nuova terapia CAR-T.
Dato che si tratta del primo trattamento nel suo genere, prima terapia cellulare antitumorale al mondo, e che potrebbe 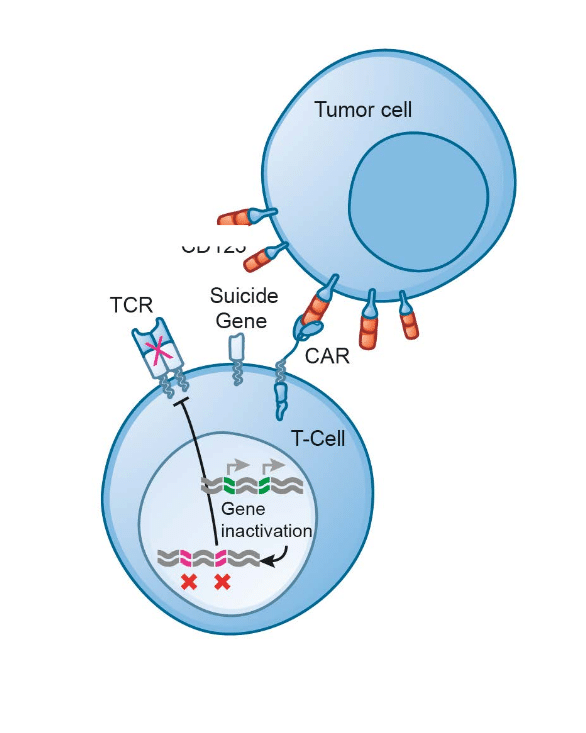 rappresentate una svolta nelle lotta ad alcune neoplasie, facciamo in questo caso un’eccezione.
rappresentate una svolta nelle lotta ad alcune neoplasie, facciamo in questo caso un’eccezione.
CAR-T fa parte dei medicinali per terapie avanzate (ATMP) cioè di quei medicinali per uso umano basati su geni, tessuti o cellule. Offrono nuove opportunità rivoluzionarie per il trattamento di malattie e lesioni.
L’Ema (Chmp) ha raccomandato alle agenzie regolatorie l’approvazione della terapia CAR-T per due patologie: il linfoma diffuso a grandi cellule B e la leucemia linfoblastica acuta.
La leucemia linfoblastica acuta (ALL) e il linfoma diffuso a grandi cellule B (DLBCL) sono due tumori rari molto aggressivi e particolarmente difficili da trattare.
La leucemia linfoblastica acuta colpisce uno specifico tipo di globuli bianchi, i linfociti, cellule che fanno parte del sistema immunitario umano. In Europa, la patologia rappresenta circa l’80% dei casi di leucemia tra i bambini. I pazienti con ALL recidivante o refrattaria (ALL r/r) hanno opzioni terapeutiche limitate, e meno del 10% di essi raggiunge i 5 anni di sopravvivenza dalla diagnosi.
Il linfoma diffuso a grandi cellule B è un tumore che coinvolge i linfociti B (o cellule B), ed è la più comune forma di linfoma non-Hodgkin (NHL), rappresentando circa il 40% dei casi di NHL a livello globale. Se non trattati, i pazienti con DLBCL recidivante o refrattario (DLBCL r/r) hanno un’aspettativa di vita di circa 6 mesi.
Il trattamento standard prevede la chemioterapie e, quando si ripresenta la malattia, il trapianto di midollo. Restano però dei casi che non rispondono a nessuna delle terapie standard. E proprio a questi pazienti potrebbe essere destinata la nuova terapia Car-T.
L’Agenzia europea dei medicinali (EMA) ha raccomandato le prime due autorizzazioni all’immissione in commercio per i medicinali contenenti le cellule T dei recettori dell’antigene chimerico (CAR) nell’Unione europea (UE). Kymriah (tisagenlecleucel, Novartis) e Yescarta (axicabtagene ciloleucel, Kite Pharma Gilead)
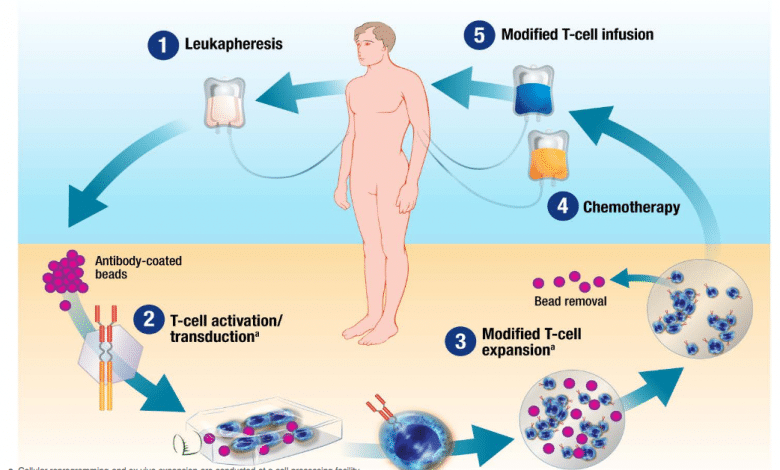
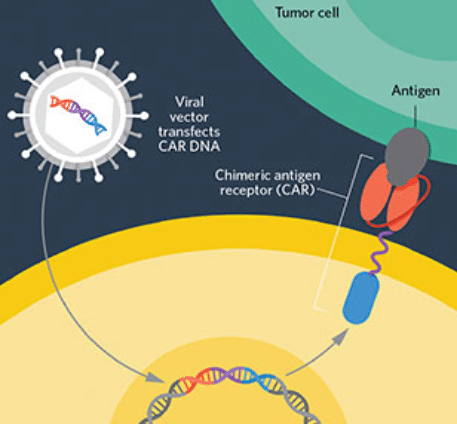
Chimeric Antigen Receptor T-cell (cellule CAR T) è un recettore posto sulla superficie dei linfociti capace di aumentare la risposta immunitaria e descrive un complesso procedimento in cui in alcune cellule del sistema immunitario, i linfociti T, viene inserita, con un vettore virale (TCR), una porzione di Dna con l’informazione in grado di produrre il recettore antigenico che riconosce le cellule malate e aggredirle.
 Si tratta dunque di un’evoluzione dell’immunoterapia, la quale prevede invece che il sistema immunitario venga stimolato da farmaci specifici da utilizzare su diversi pazienti. Si tratta quindi di un nuovo e complesso approccio terapeutico “personalizzato” contro la malattia.
Si tratta dunque di un’evoluzione dell’immunoterapia, la quale prevede invece che il sistema immunitario venga stimolato da farmaci specifici da utilizzare su diversi pazienti. Si tratta quindi di un nuovo e complesso approccio terapeutico “personalizzato” contro la malattia.
I linfociti T estratti vengono inviati nel laboratorio dell’azienda farmaceutica dove vengono geneticamente riprogrammati. Il CAR conferisce specificità contro un antigene di superficie della cellula bersaglio tumorale, più comunemente il marcatore CD19 delle cellule B del infoma diffuso.
Dopo l’infusione, le cellule TAC (Transit-Amplifying Cell) si espandono e persistono, consentendo la sorveglianza continua del tumore. Diversi costrutti di cellule T anti-CD19 hanno indotto ritmi di risposta elevati in popolazioni pesantemente pre-trattate, sebbene la durata della risposta sia varia.
La sindrome da rilascio di citochine (CRS) e la neurotossicità, che si presenta in circa il 25% dei pazienti, sono i principali ostacoli ad un’ampia implementazione della terapia con cellule T CAR. La CRS può essere trattata con successo con RoActemra (tocilizumab). Il CHMP ha inoltre raccomandato di aggiungere il trattamento del CRS indotto da cellule CAR-T come indicazione per questo medicinale.
Non tutti i pazienti possono essere candidati a questo trattamento, riservato ai malati “in buone condizioni generali”, che possono attendere i tempi necessari per il laboratorio (almeno tre settimane) e sopportare gli effetti collaterali.
La complessità sta nel fatto che per attuare la terapia occorrono i centri per l’estrazione dei globuli bianchi, la loro manipolazione e il successivo reimpianto. A quanto ci è dato sapere, Novartis sta realizzando un’infrastruttura globale per la fornitura di terapie cellulari CAR-T, laddove prima non ne esisteva alcuna.
Novartis sta perseguendo attivamente diverse opzioni per espandere la sua capacità produttiva oltre a quella della struttura di Morris Plains, nel New Jersey. Queste comprendono l’accordo con CellForCure situato in Francia, uno dei primi e più vasti Cdmo (organizzazione di sviluppo e produzione a contratto) che produce terapie geniche e cellulari in Europa; l’alleanza 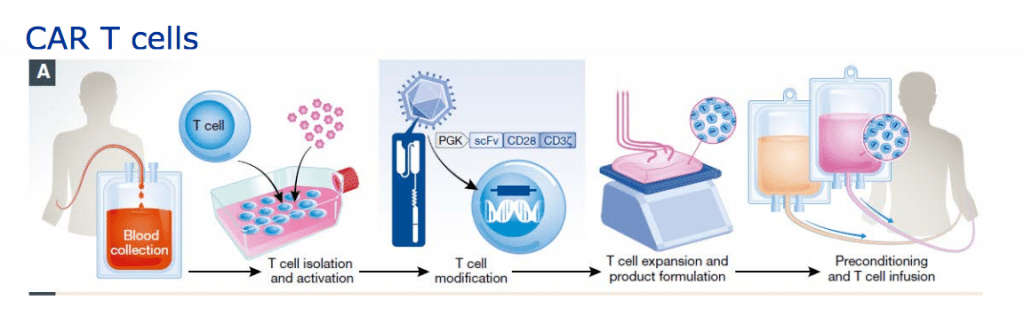 allargata con il Fraunhofer Institute, che attualmente supporta la produzione di tisagenlecleucel per le sperimentazioni cliniche globali e per la produzione post-approvazione, nonché l’impegno nel trasferimento tecnologico a un Cdmo in Giappone.
allargata con il Fraunhofer Institute, che attualmente supporta la produzione di tisagenlecleucel per le sperimentazioni cliniche globali e per la produzione post-approvazione, nonché l’impegno nel trasferimento tecnologico a un Cdmo in Giappone.
E’ ancora incerto se l‘immunoterapia CAR-T possa portare benefici anche a pazienti con tumori solidi. Anche se centinaia di studi clinici stanno esplorando una varietà di antigeni associati a questo tumore (TAA), non è stato ancora identificato un antigene con proprietà simili al CD19.
Problematico poi il costo delle terapie. Negli USA, già introdotto nell’agosto 2017, ha un costo di $475.000 il trattamento della  Novartis e di $373.000 quello della Gilead, ma che secondo alcune stime, e considerando tutte le attività cliniche richieste, possono arrivare anche ad 1 milione di dollari per paziente. Negli USA è stato adottato un sistema di payment by results, che prevede il pagamento solo nel caso in cui le terapie funzionino.
Novartis e di $373.000 quello della Gilead, ma che secondo alcune stime, e considerando tutte le attività cliniche richieste, possono arrivare anche ad 1 milione di dollari per paziente. Negli USA è stato adottato un sistema di payment by results, che prevede il pagamento solo nel caso in cui le terapie funzionino.
Kymriah e Yescarta sono comunque le prime medicine supportate dallo schema PRIority MEdicines (PRIME) dell’EMA che hanno ricevuto pareri positivi dal comitato per i medicinali per uso umano (CHMP). Lo schema volontario fornisce un sostegno scientifico e normativo precoce e rafforzato ai farmaci che hanno il potenziale per affrontare, in misura significativa, le esigenze mediche insoddisfatte dei pazienti. A Kymriah è stata concessa l’idoneità a PRIME il 23 giugno 2016, per il trattamento della leucemia linfoblastica acuta (ALL). Il 26 maggio 2016 Yescarta è stato ammesso a PRIME per il trattamento del linfoma diffuso a grandi cellule B (DLBCL).
I pareri del CHMP sono stati ora approvati dalla Commissione europea per l’adozione delle decisioni sulle autorizzazioni all’immissione in commercio a livello dell’UE. Una volta che le autorizzazioni all’immissione in commercio sono state concesse, le decisioni in merito al prezzo e al rimborso si svolgeranno a livello di ciascuno Stato membro, tenendo conto del ruolo / uso potenziale di tali medicinali nel contesto del sistema sanitario nazionale di tale paese. Considerando che il numero di pazienti potenzialmente da trattare non è particolarmente elevato, si può ipotizzare che il SSN italiano lo rimborsi.
Related news: First two CAR-T cell medicines recommended for approval in the European Union 06/29/2018
Development of Kymriah and Yescarta supported through PRIME
Car-Ts are coming: can we afford them?
Acute lymphoblastic leukemia (ALL)
Breast cancer treated with cells from the same patient: the result is surprising





