
Con riferimento ai medicinali omeopatici che ricadono nella disciplina della Legge 190/2014, art. 1, comma 590 e della Legge 160/2019 art. 1, comma 464, si rendono disponibili gli aggiornamenti degli elenchi dei medicinali omeopatici autorizzati alla commercializzazione sul territorio italiano.
In particular:
- Viene pubblicato l’elenco delle confezioni dei medicinali omeopatici in possesso di AIC rilasciata a
 conclusione del procedimento di valutazione della domanda di rinnovo dell’autorizzazione ope legis ai sensi della Legge 190/2014, art. 1, comma 590, aggiornato al 31 agosto 2024. In tale elenco sono riportate anche le nuove confezioni dei medicinali omeopatici autorizzate successivamente al rilascio dell’AIC;
conclusione del procedimento di valutazione della domanda di rinnovo dell’autorizzazione ope legis ai sensi della Legge 190/2014, art. 1, comma 590, aggiornato al 31 agosto 2024. In tale elenco sono riportate anche le nuove confezioni dei medicinali omeopatici autorizzate successivamente al rilascio dell’AIC; - Viene pubblicato l’elenco dei medicinali omeopatici autorizzati alla commercializzazione ope legis in accordo alle previsioni legislative sopra riportate, nelle more della valutazione del dossier da parte dell’Agenzia.
Si ricorda che per i medicinali omeopatici che hanno ottenuto l’AIC, fino al termine dello smaltimento delle scorte eventualmente concesso, è possibile trovare sul mercato confezioni nelle quali non è indicato il numero di AIC e le informazioni relative al prodotto non sono state ancora aggiornate con quelle autorizzate nel provvedimento autorizzativo.
Inoltre, l’elenco dei medicinali omeopatici autorizzati alla commercializzazione ope legis, riporta i prodotti così come presentati dall’Azienda richiedente in fase di presentazione dell’istanza e, pertanto, potrebbero subire modifiche fino al completamento della procedura. Quest’ultimo elenco include anche medicinali omeopatici per i quali la valutazione da parte dell’AIFA si è conclusa positivamente, ma il cui provvedimento autorizzativo è in corso di elaborazione.
Gli elenchi sono oggetto di aggiornamento periodico.
AIFA – Pubblicato il: 02 settembre 2024
AIFA – Medicinali omeopatici
I medicinali omeopatici sono dei prodotti ottenuti utilizzando sostanze di origine minerale, chimica, vegetale, animale e biologica (definite ceppi omeopatici) attraverso metodi di produzione specifici, definiti nelle farmacopee ufficiali. (Farmacopea Europea o Farmacopea Francese o Farmacopea Omeopatica Tedesca).
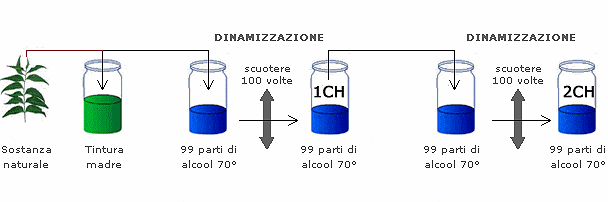 La caratteristica dei medicinali omeopatici è quella di utilizzare sostanze altamente diluite e “dinamizzate”. Il processo di diluizione solitamente è responsabile dell’effetto di non rilevabilità del contenuto di partenza del ceppo omeopatico. In tali casi, il medicinale finito risulta, dal punto di vista chimico-fisico, unicamente costituito da eccipienti.
La caratteristica dei medicinali omeopatici è quella di utilizzare sostanze altamente diluite e “dinamizzate”. Il processo di diluizione solitamente è responsabile dell’effetto di non rilevabilità del contenuto di partenza del ceppo omeopatico. In tali casi, il medicinale finito risulta, dal punto di vista chimico-fisico, unicamente costituito da eccipienti.
Tuttavia, alcuni medicinali omeopatici possono essere costituiti da sostanze in concentrazione ponderale (ovvero analiticamente rilevabile), oppure direttamente da tinture madri or macerati glicerici.
Il quadro normativo di riferimento
I medicinali omeopatici attualmente in commercio in Italia hanno goduto delle disposizioni transitorie definite dall’art. 20 del D.lgs. 219/2006 che ha permesso ai prodotti già presenti sul mercato alla data del 6 giugno 1995 di rimanere in commercio, in virtù di una disposizione ope legis. Tali disposizioni transitorie sono terminate il 31 dicembre 2019.
 La legge n.190/2014 ha disposto che, per ottenere un rinnovo dell’autorizzazione alla commercializzazione, il titolare dovesse depositare in AIFA i dossier di registrazione entro il 30 giugno 2017. L’Agenzia, in caso di valutazione favorevole del dossier, concede un’autorizzazione all’immissione in commercio.
La legge n.190/2014 ha disposto che, per ottenere un rinnovo dell’autorizzazione alla commercializzazione, il titolare dovesse depositare in AIFA i dossier di registrazione entro il 30 giugno 2017. L’Agenzia, in caso di valutazione favorevole del dossier, concede un’autorizzazione all’immissione in commercio.
Con Legge 160/2019 è stato stabilito il proseguo della commercializzazione per i prodotti interessati da un procedimento di richiesta di AIC depositata all’ AIFA entro il 30 giugno 2017, mentre per gli altri prodotti, per i quali il titolare non ha presentato la domanda di rinnovo, è stato concesso lo smaltimento delle scorte presenti nel canale distributivo alla data del 1 gennaio 2020, fino alla data di scadenza indicata in etichetta e comunque non oltre il 1 gennaio 2022.
Aggiornamento elenchi medicinali omeopatici
Note:
D.Lgs. 219/06 – Capo II
SPECIAL RULES APPLICABLE TO HOMEOPATHIC MEDICINES
Article 16.
Simplified registration procedure
1. A homeopathic medicinal product is subject, for the purposes of placing it on the market, to a simplified registration procedure, only if the medicinal product:
a) it is intended to be administered orally or externally;
b) does not bear specific therapeutic indications on the label or in the information of any kind referring to the product;
c) has a degree of dilution such as to guarantee its safety; in any case, the medicinal product cannot contain more than one part per ten thousand of mother tincture, nor more than 1/100 of the smallest dose possibly used in allopathy for active substances whose presence in an allopathic medicinal product implies the obligation to submit a prescription.
2. Any new parameters concerning the safety of the homeopathic medicinal product shall be adopted by decree of the Minister of Health to replace or supplement those envisaged by letter c) of paragraph 1, in accordance with the provisions of the European Community.
3. At the time of registration, AIFA establishes the supply regime of the medicinal product.
4. The provisions of articles 8, paragraph 3, 29, paragraph 1, from 33 to 40, 52, paragraph 8, letters a), b) and c), and 141 apply, by analogy, to the simplified procedure for the registration of medicinal products homeopathic, with the exception of trials of therapeutic efficacy.
Article 17.
Content of the simplified registration application
1. The simplified registration application may concern a series of medicinal products obtained from the same starting materials for homeopathic preparations or homeopathic strains.
2. In any case, the simplified registration application, to be submitted in accordance with a specific model established by AIFA within three months of the date of entry into force of this decree and published in the Official Gazette of the Italian Republic, must contain and be accompanied by the following data and documents intended, in particular, to demonstrate the pharmaceutical quality and the homogeneity of the production batches:
a) scientific name of the starting material or materials for homeopathic preparations or homeopathic strains or other name appearing in a pharmacopoeia, with indication of the different routes of administration, pharmaceutical forms and degrees of dilution to be recorded;
b) proper denomination of the homeopathic tradition;
c) dossier describing the methods by which each starting material for homeopathic preparations or homeopathic strains is obtained and controlled and demonstrates its homeopathic use through an adequate bibliography;
d) documentation concerning the production and control methods for each pharmaceutical form and a description of the dilution and dynamisation methods;
e) authorization for the production of medicinal products covered by the application;
f) copy of any registration or authorization obtained for the same medicinal product in other Member States of the European Community;
g) a model of the outer packaging and the immediate packaging of the medicinal products to be registered;
h) data concerning the stability of the medicinal product.
Article 18.
Homeopathic medicines to which the simplified registration procedure does not apply
1. Homeopathic medicinal products other than those referred to in article 16, paragraph 1, must be authorized and labeled in accordance with articles 8, 10, 11, 12, 13 and 14. As regards the documentation presented in support of the application, applies the provisions of article 8, paragraph 4. For these products, specific rules relating to preclinical tests and clinical trials may be provided for by decree of the Minister of Health, on a proposal from AIFA, in line with the principles and characteristics of homeopathic medicine practiced in Italy.
2. Title IX of this decree applies to homeopathic medicinal products, with the exception of those to which article 16, paragraph 1 refers.
Article 19.
Community communications
1. AIFA communicates to the other Member States of the European Community all the information necessary to guarantee the quality and safety of the homeopathic medicinal products produced and marketed in the European Community.
Article 20.
Disposizione transitoria sui medicinali omeopatici; estensione della disciplina ai medicinali antroposofici
1. For homeopathic medicinal products present on the Italian market on 6 June 1995, the provisions of the legislation in force on the date of entry into force of this decree remain unchanged; the authorization or simplified registration of these products is issued according to the provisions of this decree.
2. Ai prodotti di cui al comma 1 si applicano, in ogni caso, le disposizioni previste dal titolo IX [ndr: farmacovigilanza] .
3. Anthroposophic medicines described in an official pharmacopoeia and prepared according to a homeopathic method are comparable, for the purposes of this decree, to homeopathic medicines.





