L’ISF E LA FARMACOVIGILANZA
Legislative decree n. 219 of 24 April 2006
Art.122,
comma 6: Gli informatori scientifici devono riferire al servizio scientifico di cui all’articolo 126, dal quale essi dipendono, ed al responsabile del servizio di farmacovigilanza di cui al comma 4 dell’articolo 130, tutte le informazioni sugli effetti indesiderati dei medicinali, allegando, ove possibile, copia delle schede di segnalazione utilizzate dal medico ai sensi del titolo IX.
Article 126.
Scientific service
1. Ogni impresa titolare dell’AIC di medicinali deve essere dotata di un scientific service responsible for information on medicinal products che immette sul mercato. Il servizio e’ diretto da un laureato in possesso del diploma di laurea in medicina e chirurgia o in farmacia o in chimica e tecnologia farmaceutiche ai sensi della legge 19 novembre 1990, n. 341, o in possesso di laurea specialistica o magistrale appartenente alle classi di laurea specialistica o magistrale cui fanno riferimento i settori scientifico-disciplinari dei diplomi di laurea sopra indicati, medicina e chirurgia, farmacia, chimica e tecnologia farmaceutiche. Il Servizio scientifico deve essere indipendente dal Servizio marketing dell’impresa farmaceutica.
to) si assicura che la pubblicità farmaceutica della propria impresa e’ conforme alle prescrizioni del presente decreto;
b) verifica che gli informatori scientifici alle proprie dipendenze sono in possesso di una formazione adeguata e rispettino gli obblighi imposti dal presente decreto;
Article 130.
Provisions concerning the marketing authorization holder
4. Il titolare dell’AIC di medicinali deve disporre, a titolo stabile e continuativo, di un responsabile del servizio di farmacovigilanza, in possesso, fatte salve le situazioni regolarmente in atto alla data di entrata in vigore del presente decreto, della laurea in medicina e chirurgia o in farmacia, o in chimica e tecnologia farmaceutiche, ai sensi della legge 19 novembre 1990, n. 341, o rispettive lauree specialistiche di cui al citato decreto ministeriale 3 novembre 1999, n. 509, o lauree magistrali di cui al citato decreto ministeriale 22 ottobre 2004, n. 270. Sono altresì ritenuti validi i diplomi di laurea di cui alla legge 19 novembre 1990, n. 341, la laurea specialistica e la laurea magistrale in scienze biologiche o in chimica ad indirizzo organico-biologico purche’ il piano di studi abbia compreso almeno un esame annuale di farmacologia o 12 crediti formativi nel relativo settore scientifico-disciplinare. Il responsabile del servizio di farmacovigilanza deve essere persona diversa dal responsabile del servizio scientifico previsto dall’articolo 111 del presente decreto, e deve essere posto in condizione di usufruire di tutti i dati di tale servizio. Le competenze del responsabile si estendono a tutti i medicinali della cui AIC e’ titolare l’azienda da cui egli dipende, anche se commercializzati da altre aziende
10. The marketing authorization holder is obliged to disseminate the information notes and updates on the safety of medicinal products to the prescribing physicians, according to the indications, times and methods established by AIFA, whenever new information emerges relating to the tolerability profile of the medicinal product .
Article 131.
Responsible for the pharmacovigilance service
1. The person in charge of the pharmacovigilance service referred to in paragraph 4 of article 130 resides in a member country of the European Community; he assures:
to) l’istituzione ed il funzionamento di un sistema atto a garantire che le informazioni su tutte le presunte reazioni avverse comunicate al personale dell’azienda ed agli medical-scientific informants, are collected, sorted and accessible in one place;
b) che tutte le informazioni relative alla sicurezza dei medicinali, successive all’atto dell’autorizzazione, siano portate rapidamente a conoscenza del personale sanitario anche through the contacts of the scientific information service della propria azienda;
NB.: L’ISF deve sempre avere in borsa il modulo di segnalazione di reazioni avverse
______________________________________________________________
Obbligo segnalazione sospette reazioni avverse al massimo entro 48h. Il Decreto in Gazzetta Ufficiale. E’ previsto un maggiore impegno e coinvolgimento di tutte le strutture e figure professionali
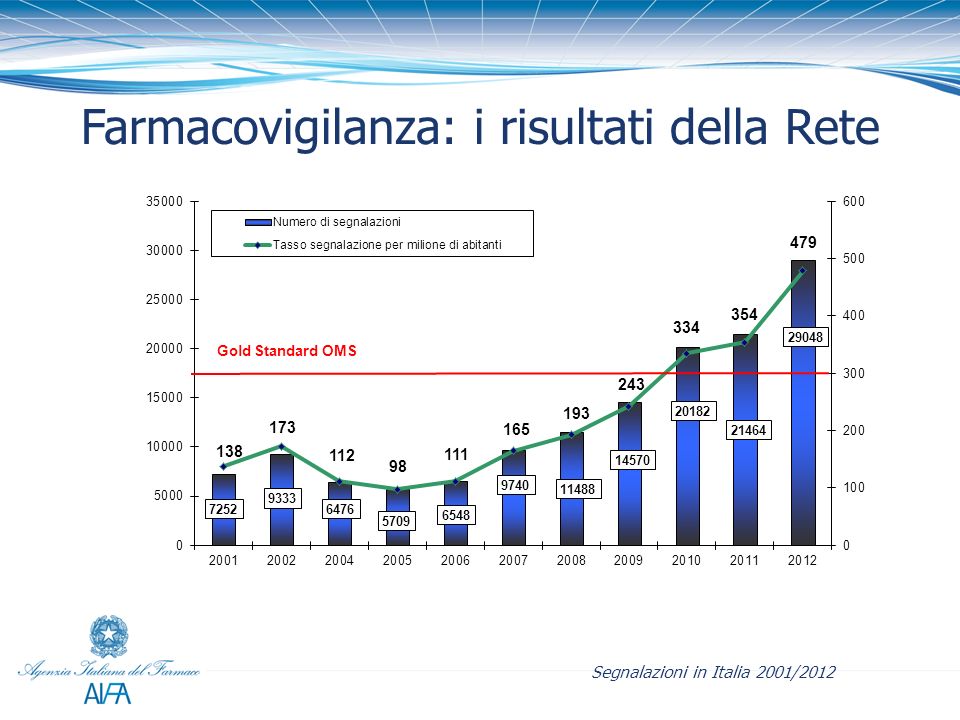 E’ stato pubblicato nella Gazzetta Ufficiale n. 143 del 23 giugno 2015 il decreto Ministeriale del 30 aprile 2015 che recepisce le direttive europee sulla pharmacovigilance (Direttive 2010/84/EU e 2012/26/UE). In particolare, il decreto introduce importanti modifiche sul sistema nazionale di pharmacovigilanceper la raccolta e valutazione delle segnalazioni di sospette reazioni avverse da medicinali.
E’ stato pubblicato nella Gazzetta Ufficiale n. 143 del 23 giugno 2015 il decreto Ministeriale del 30 aprile 2015 che recepisce le direttive europee sulla pharmacovigilance (Direttive 2010/84/EU e 2012/26/UE). In particolare, il decreto introduce importanti modifiche sul sistema nazionale di pharmacovigilanceper la raccolta e valutazione delle segnalazioni di sospette reazioni avverse da medicinali.
E’ previsto un maggiore impegno e coinvolgimento di tutte le strutture e figure professionali quali l’AIFA, le Regioni, le ASL, gli Ospedali, gli IRCCS, le aziende farmaceutiche, gli operatori sanitari e i pazienti/cittadini. In particolar modo, agli operatori sanitari e ai pazienti/cittadini è richiesto di segnalare qualsiasi tipo di sospetta adverse reaction (grave, non grave, nota, non nota), sia derivante dall’uso di un medicinale conformemente all’autorizzazione all’immissione in commercio (AIC), sia dall’uso al di fuori delle normali condizioni di autorizzazione, incluso l’uso improprio e l’abuso del medicinale, ma anche dagli errori terapeutici e dall’esposizione professionale. L’ampliamento della definizione di adverse reaction fa sì che nuove problematiche siano analizzate e che vengano sviluppate delle iniziative di minimizzazione dei rischi ad esse connessi, nello spirito di proattività della nuova legislazione comunitaria in materia di pharmacovigilance.
Il decreto introduce inoltre una tempistica ben precisa per la segnalazione delle sospette reazioni avverse: ll segnalatore è adesso tenuto a trasmettere la scheda entro 2 giorni, ridotti a 36 ore nel caso di farmaci di origine biologica (vaccini inclusi), al responsabile della pharmacovigilance della struttura sanitaria di competenza (ASL, Azienda Ospedaliera, IRCCS), il quale, entro 7 giorni dal ricevimento della scheda, deve inserirla nella RNF previa verifica della completezza e della congruità dei dati. Questa disposizione favorirà l’individuazione precoce dei segnali di sicurezza assicurando una segnalazione tempestiva delle reazioni avverse.
 Un’altra novità rispetto al passato è costituita dal fatto che i pazienti/cittadini sono fortemente incoraggiati a segnalare le sospette reazioni avverse da medicinali ed è incentivata la loro attiva partecipazione. Al fine di incoraggiare i pazienti/cittadini e gli operatori sanitari alla segnalazione, il decreto prevede che questa possa avvenire direttamente tramite il portale web dell’AIFA. Quest’ultima modalità, attualmente in fase di progetto pilota, richiederà comunque una validazione da parte del Responsabile di FV della struttura sanitaria di appartenenza del segnalatore.
Un’altra novità rispetto al passato è costituita dal fatto che i pazienti/cittadini sono fortemente incoraggiati a segnalare le sospette reazioni avverse da medicinali ed è incentivata la loro attiva partecipazione. Al fine di incoraggiare i pazienti/cittadini e gli operatori sanitari alla segnalazione, il decreto prevede che questa possa avvenire direttamente tramite il portale web dell’AIFA. Quest’ultima modalità, attualmente in fase di progetto pilota, richiederà comunque una validazione da parte del Responsabile di FV della struttura sanitaria di appartenenza del segnalatore.
E’ prevista, inoltre, la stretta collaborazione dei Centri regionali di pharmacovigilance (CRFV) con l’AIFA, soprattutto per l’attività di identificazione di nuovi segnali di sicurezza e per lo sviluppo di azioni mirate al monitoraggio della sicurezza dei medicinali.
Per quanto riguarda le procedure di minimizzazione dei rischi, la principale novità consiste nella possibilità per l’AIFA di imporre alle aziende titolari dell’autorizzazione di medicinali delle condizioni vincolanti che assicurino l’uso sicuro del medicinale. Tali misure consistono essenzialmente nella conduzione di studi clinici di efficacia e sicurezza nel periodo post-autorizzazione, nonché nella conduzione di verifiche del rispetto degli obblighi di segnalazione delle reazioni avverse da parte delle autorità regolatorie.
Inoltre, la persona qualificata responsabile della pharmacovigilance, di cui le aziende titolari di autorizzazione di medicinali devono disporre a titolo stabile e continuativo, deve ora dimostrare il possesso di documentata esperienza nel campo della pharmacovigilance e provvedere a registrare se stesso o la persona di contatto alla Rete Nazionale di Pharmacovigilance.
Un punto essenziale del nuovo decreto è la trasparenza: tutte le informazioni importanti inerenti la sicurezza dei medicinali devono essere rese tempestivamente accessibili al pubblico. A questo scopo, il portale web dell’AIFA continuerà a giocare un ruolo fondamentale.
Infine, viene sottolineata l’importanza dell’esistenza di un adeguato ed efficace sistema di qualità per lo svolgimento delle attività di pharmacovigilance sia a livello delle autorità competenti che dei titolari di autorizzazione all’immissione in commercio. Pertanto, al fine di garantirne il continuo miglioramento, tutti i sistemi di qualità delle agenzie europee responsabili per la pharmacovigilance devono essere sottoposti ad audit periodici e i risultati riferiti ogni due anni alla Commissione Europea.
Farmacovigilanza, Cini: cambia la definizione di reazione avversa
Il decreto ministeriale recentemente pubblicato in Gazzetta, che attua la direttiva 2012/26/UE, introduce nuove norme in materia di farmacovigilanza. Tra gli aspetti più rilevanti, segnalati da Maurice Cini, docente dell’Università di Bologna, oltre l’obbligo alla segnalazione, una nuova definizione di reazione avversa dovuta, non solo all’uso autorizzato di un medicinale alle normali condizioni di impiego, ma anche a errori, uso improprio e abuso.
Con D.M. 30 aprile 2015, in G.U. n. 143 del 23 giugno 2015, e con due anni e mezzo di ritardo rispetto alla previsione di legge, è stata data attuazione alla direttiva 2012/26/UE che introduce nuove norme in materia di farmacovigilanza.
Tra gli aspetti più rilevanti vi è l’obbligo di segnalazione di qualsiasi reazione avversa in seguito all’assunzione di medicinali. Il decreto prevede infatti che la segnalazione va fatta sia per reazioni avverse gravi o non gravi che per quelle note e non note, comprese quelle a seguito di assunzione nel rispetto delle modalità autorizzate ma anche di quelle derivanti da uso improprio o abuso del farmaco.
La novità sta infatti nella nuova definizione di reazione avversa: la reazione nociva e non voluta conseguente non solo all’uso autorizzato di un medicinale alle normali condizioni di impiego ma anche agli errori terapeutici e agli usi non conformi alle indicazioni contenute nell’autorizzazione all’immissione in commercio, incluso l’uso improprio e l’abuso del medicinale.
La pericolosità di un medicinale dipende infatti anche dall’uso improprio, non considerato in fase di sperimentazione.
L’obbligo di segnalazione prevede tempistiche ridotte a due giorni per tutti i medicinali tranne per quelli di origine biologica per i quali è previsto il tempo massimo di 36 ore dalla intervenuta conoscenza della reazione. Anche i pazienti sono invitati a effettuare le segnalazioni mediante le apposite schede direttamente al responsabile di farmacovigilanza della struttura sanitaria o anche direttamente dal portale dell’AIFA: aifa.gov.it.
A questo punto appare indispensabile una sensibilizzazione dei farmacisti, citati nell’ambito de “gli altri operatori sanitari”, a farsi parte attiva presso i propri clienti/pazienti raccogliendo le segnalazioni e trasmettendole secondo la normativa. E’ superfluo ricordare come, fino ad ora, la modestissima entità delle segnalazioni provenienti da farmacie (ma anche dalle “parafarmacie”) abbia influito negativamente sull’immagine stessa della professione di farmacista.
Le segnalazioni di reazioni avverse verificatesi sul territorio nazionale e trasmesse alla banca dati Eudravigilance da parte dei titolari di Aic possono determinare il loro coinvolgimento da parte di AIFA in una azione di controllo delle segnalazioni. Inoltre i rapporti periodici sulla sicurezza del medicinale, Psur, possono anche determinare il mantenimento, la modifica, la sospensione o la revoca dell’Aic. Tali decisioni, per i medicinali autorizzati in più Stati membri, vengono prese di concerto con gli altri Paesi, conformandosi entro 30 giorni alla decisione adottata dalla Commissione europea.
Con il provvedimento di recepimento, l’Italia si pone così al passo degli altri paesi UE in materia di sicurezza sull’uso dei medicinali.
Prof. Maurice Cini
Bologna University