
Definizione di status di farmaco orfano
economia e finanza – 11 luglio 2021
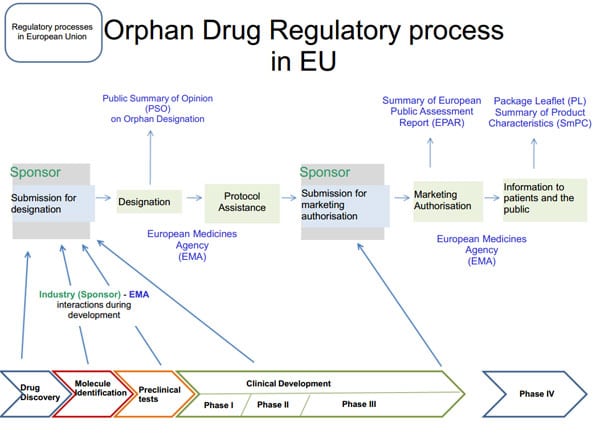 Lo status di farmaco orfano offre alle aziende che stanno ricercando trattamenti per le malattie rare una finestra di riduzione delle tasse di sette anni e il diritto esclusivo di sviluppare trattamenti per malattie specifiche. Lo stato di farmaco orfano può essere concesso a nuovi farmaci, farmaci approvati o farmaci già sul mercato. Tuttavia, se il farmaco è stato approvato, lo sponsor deve presentare un’ipotesi ragionevole su come il farmaco sia clinicamente superiore ai farmaci precedenti o non sviluppati.
Lo status di farmaco orfano offre alle aziende che stanno ricercando trattamenti per le malattie rare una finestra di riduzione delle tasse di sette anni e il diritto esclusivo di sviluppare trattamenti per malattie specifiche. Lo stato di farmaco orfano può essere concesso a nuovi farmaci, farmaci approvati o farmaci già sul mercato. Tuttavia, se il farmaco è stato approvato, lo sponsor deve presentare un’ipotesi ragionevole su come il farmaco sia clinicamente superiore ai farmaci precedenti o non sviluppati.
Punti chiave
- Lo status di farmaco orfano conferisce all’azienda diritti esclusivi di marketing e sviluppo e altri vantaggi per recuperare il costo dello sviluppo di farmaci per le malattie rare.
- L’Orphan Drug Act mira a incoraggiare le aziende a sviluppare farmaci per le malattie rare.
- La FDA può revocare lo status di farmaco orfano.
- Tuttavia, rispetto a malattie e condizioni costose e rare, le aziende farmaceutiche preferiscono trattare malattie e condizioni più economiche.
Comprendere lo status dei farmaci orfani
Nel 1982, gli Stati Uniti Food and Drug Administration (FDA) riconosce che le aziende farmaceutiche mancano della motivazione per sviluppare trattamenti per le malattie rare. Sulla base di questo riconoscimento è nato l’Orphan Drug Act del 1983.Il piano mira a colpire le malattie che colpiscono meno di 200.000 persone negli Stati Uniti.
L’Office of Orphan Product Development (OOPD) incoraggia le aziende a esercitare i propri diritti ai sensi dell’Orphan Drugs Act del 1983. L’OOPD sviluppa e assegna sovvenzioni per aziende, biologi, clinici e ricercatori che desiderano sviluppare prodotti e farmaci per il trattamento di queste malattie rare.La legge fa riferimento a questi gruppi come sponsor.
L’Orphan Drug Act è stato rivisto molte volte per includere prodotti diversi dai farmaci, come prodotti biologici, dispositivi medici e alimenti medici (principalmente alimenti prenatali).
Articoli di attenzione speciale
 Come tutti sappiamo, le aziende farmaceutiche sono prima le imprese e poi i terapisti.Le aziende farmaceutiche spendono miliardi di dollari ogni anno per R&S Ad esempio, Pfizer (PFE) avrà un fatturato di 41,908 miliardi di dollari nel 2020. La spesa in ricerca e sviluppo quell’anno è stata di circa 9,4 miliardi di dollari. Ciò equivale al 22,4% dei ricavi dedicati alla ricerca e sviluppo.
Come tutti sappiamo, le aziende farmaceutiche sono prima le imprese e poi i terapisti.Le aziende farmaceutiche spendono miliardi di dollari ogni anno per R&S Ad esempio, Pfizer (PFE) avrà un fatturato di 41,908 miliardi di dollari nel 2020. La spesa in ricerca e sviluppo quell’anno è stata di circa 9,4 miliardi di dollari. Ciò equivale al 22,4% dei ricavi dedicati alla ricerca e sviluppo.
Se l’azienda non riesce a ottenere un brevetto, anche lo sviluppo di nuovi farmaci è un’attività rischiosa. C’è anche una forte concorrenza di farmaci contraffatti e farmaci generici o farmaci simili. Molte aziende vanno in posti dove è relativamente facile fare soldi.
I pro e i contro dei farmaci orfani
Oltre alla ricerca sui diritti esclusivi e sui crediti d’imposta, la FDA fornirà anche assistenza tecnica per le domande di farmaci orfani, approvazioni che possono ridurre il periodo di attesa e sconti sulle tasse di registrazione. Lo stato prevede anche il 25% Credito d’imposta Per quanto riguarda il costo delle sperimentazioni cliniche.
Lo status di farmaco orfano non è concepito per consentire agli sponsor di recuperare tutti i costi di sviluppo del farmaco, ma per ridurre i costi e semplificare i meccanismi regolatori. La FDA può revocare facilmente la designazione di farmaco orfano. I motivi comuni includono: dichiarazioni non veritiere o informazioni mancanti nella richiesta di designazione o la FDA ritiene che la malattia o la condizione colpirà più di 200.000 persone in futuro.
Lo sviluppo di farmaci per curare un gran numero di malattie nel mondo è un business che può portare enormi ricchezze. Tuttavia, nell’industria farmaceutica, la maggior ricchezza si ottiene spesso attraverso lo sviluppo di farmaci standard per il trattamento di malattie comuni. Da un punto di vista commerciale, avere un mercato ampio può garantire alle aziende di recuperare rapidamente i costi di sviluppo e ottenere i massimi benefici.
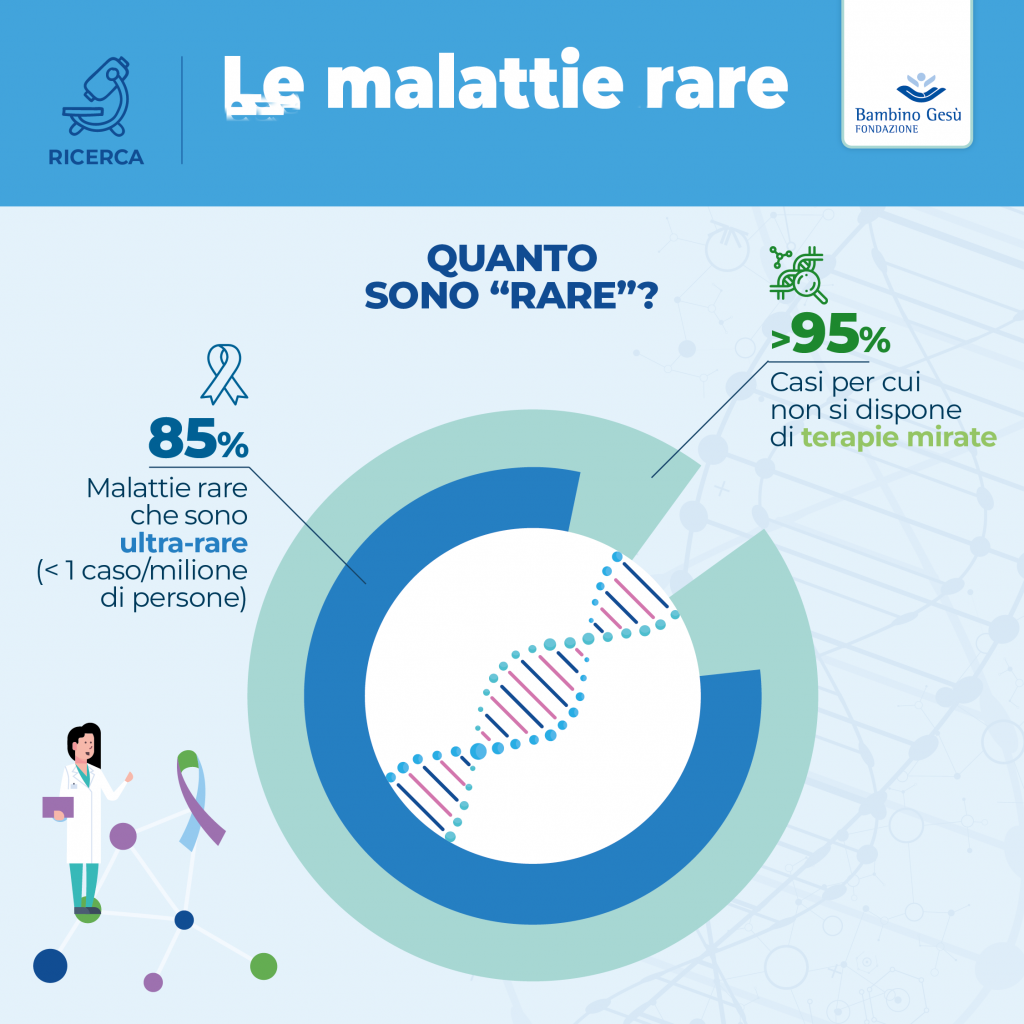
Nota: In Europa una malattia è considerata rara quando colpisce non più di 5 persone ogni 10.000 abitanti.
Notizie correlate: AIFA. Farmaci orfani
Liste farmaci orfani 31 dicembre 2020 [0.14 Mb]
Governo. Malattie rare. Farmaci orfani (normativa)
Malattie rare e farmaci orfani, presentato il 4° Rapporto OSSFOR
Farmaci orfani a furia di incentivi per le aziende sono diventati un affare





