
Roma, 24 gennaio – Con un comunicato stampa diffuso ieri, la Corte di Giustizia dell’Unione europea (Curia) ha reso noti i contenuti della sentenza pronunciata sul caso Avastin-Lucentis, rinviato ai giudici europei dal Consiglio di Stato dopo che Roche e Novartis avevano impugnato la pronuncia del Tar Lazio con la quale era stato respinto il loro ricorso contro la pesantissima sanzione (oltre180 milioni di euro complessivi) inflitta dall’Autorità garante del mercato e della concorrenza. L’accusa alle due aziende, come si ricorderà, era quella di aver posto in essere un’intesa di cartello volta a favorire le vendite del farmaco oftalmologico Lucentis in luogo dell’analogo e molto meno costoso Avastin.
 I giudici europei hanno effettivamente riconosciuto, con la sentenza pronunciata ieri, che “l’intesa tra i gruppi farmaceutici Roche e Novartis volta a ridurre l’utilizzo in ambito oftalmico del medicinale Avastin e a incrementare quello del Lucentis potrebbe costituire una restrizione della concorrenza «per oggetto»”.
I giudici europei hanno effettivamente riconosciuto, con la sentenza pronunciata ieri, che “l’intesa tra i gruppi farmaceutici Roche e Novartis volta a ridurre l’utilizzo in ambito oftalmico del medicinale Avastin e a incrementare quello del Lucentis potrebbe costituire una restrizione della concorrenza «per oggetto»”.
La Curia, nella sua pronuncia, ricostruisce l’intera vicenda, ricordando che Avastin e Lucentis sono medicinali prodotti dalla società Genentech, appartenente al gruppo Roche. Genentech ha affidato lo sfruttamento commerciale di Lucentis al gruppo Novartis mediante un accordo di licenza. Roche, invece, commercializza Avastin.
Questi medicinali biotecnologici sono stati autorizzati dalla Commissione e dall’Ema, l’Agenzia europea per i medicinali. Lucentis è autorizzato per il trattamento delle malattie oftalmiche. Avastin, benché autorizzato solamente per il trattamento delle patologie tumorali, grazie al prezzo inferiore rispetto a quello di Lucentis è spesso utilizzato anche per il trattamento delle malattie oftalmiche.
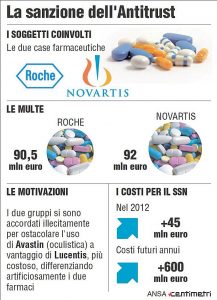
Nel 2014, l’Agcm, l’Autorità italiana garante della concorrenza e del mercato, ha inflitto due ammende, ciascuna di un importo superiore a 90 milioni di euro, alle società Roche e Novartis, per aver concluso un’intesa diretta a ottenere una differenziazione artificiosa tra Avastin e Lucentis. Secondo l’Agcm, Avastin e Lucentis sarebbero del tutto equivalenti per il trattamento di malattie oftalmiche.
L’intesa avrebbe avuto lo scopo di diffondere notizie in grado di ingenerare preoccupazioni sulla sicurezza degli usi oftalmici dell’Avastin così da produrre uno spostamento della domanda a favore di Lucentis.
L’Agcm ritiene che tale spostamento avrebbe generato, a carico del servizio sanitario italiano, costi supplementari stimati in circa 45 milioni di euro per il solo anno 2012.
 Dopo che il Tribunale amministrativo regionale per il Lazio ha respinto i loro ricorsi presentati contro le ammende, Roche e Novartis hanno proposto appello dinanzi al Consiglio di Stato italiano, che ha ritenuto di rivolgersi alla Corte di giustizia chiedendo l’interpretazione delle norme dell’Unione in materia di concorrenza.
Dopo che il Tribunale amministrativo regionale per il Lazio ha respinto i loro ricorsi presentati contro le ammende, Roche e Novartis hanno proposto appello dinanzi al Consiglio di Stato italiano, che ha ritenuto di rivolgersi alla Corte di giustizia chiedendo l’interpretazione delle norme dell’Unione in materia di concorrenza.
“Con l’odierna sentenza – si legge nel comunicato della Curia – la Corte esamina innanzitutto la questione se un’autorità nazionale garante della concorrenza, quale l’Agcm, possa ritenere che l’Avastin, sebbene non autorizzato per il trattamento delle malattie oftalmiche, faccia parte dello stesso mercato del Lucentis –specificamente autorizzato per dette malattie – e, nell’ipotesi affermativa, se tale autorità debba tener conto dell’eventuale illiceità di detto utilizzo dell’Avastin alla luce della normativa dell’Unione in materia di prodotti farmaceutici“.
La Corte ricorda che, in linea di principio, i medicinali utilizzabili per le medesime indicazioni terapeutiche appartengono allo stesso mercato. Tuttavia, il fatto che taluni medicinali siano fabbricati o venduti in modo illecito impedisce di considerarli come sostituibili a prodotti fabbricati e venduti in modo lecito.
“Ciò detto – scrive la Curia – la normativa dell’Unione in materia di prodotti farmaceutici non vieta né la prescrizione di un medicinale al di fuori delle condizioni previste dalla sua autorizzazione all’immissione in commercio (il così detto uso off label) né il suo riconfezionamento ai fini di tale uso, salvo il rispetto di talune condizioni. La verifica del rispetto di dette condizioni non spetta all’Agcm, ma ai giudici nazionali o ad altre autorità competenti in materia”.
La Corte rileva inoltreche per il trattamento delle malattie oftalmiche vi è, di fatto, un rapporto di sostituibilità tra Lucentis e Avastin utilizzato off label. La Corte conclude affermando che, se l’eventuale illiceità delle condizioni di riconfezionamento e di prescrizione di Avastin destinato all’uso off label non è stata esaminata dalle autorità o dai giudici competenti in materia, l’Agcm può ritenere i due prodotti come facenti parte del medesimo mercato e quindi come medicinali concorrenti.
Nella misura in cui l’illiceità di dette condizioni sia stata esaminata dalle autorità o dai giudici competenti in materia, l’Agcm deve invece tener conto dell’esito di tale esame.
 La Corte esclude che l’intesa tra i gruppi Roche e Novartis esaminata dall’Agcm possa essere giustificata in quanto accessoria al loro accordo di licenza. A tal proposito, la Corte sottolinea anzi che “tale intesa mirava a limitare non l’autonomia commerciale delle parti dell’accordo di licenza relativo a Lucentis, ma i comportamenti dei terzi – in particolare dei medici –per ridurre la prescrizione di Avastin in ambito oftalmico a beneficio di Lucentis. Ciò posto, l’intesa non può essere considerata accessoria e obiettivamente necessaria all’attuazione dell’accordo di licenza”.
La Corte esclude che l’intesa tra i gruppi Roche e Novartis esaminata dall’Agcm possa essere giustificata in quanto accessoria al loro accordo di licenza. A tal proposito, la Corte sottolinea anzi che “tale intesa mirava a limitare non l’autonomia commerciale delle parti dell’accordo di licenza relativo a Lucentis, ma i comportamenti dei terzi – in particolare dei medici –per ridurre la prescrizione di Avastin in ambito oftalmico a beneficio di Lucentis. Ciò posto, l’intesa non può essere considerata accessoria e obiettivamente necessaria all’attuazione dell’accordo di licenza”.
La Corte sottolinea ancora che un’intesa tra due imprese che commercializzano due medicinali concorrenti, avente ad oggetto – in un contesto d’incertezza scientifica in materia – la diffusione presso l’Ema, gli operatori sanitari e il pubblico, di informazioni ingannevoli sugli effetti collaterali negativi dell’uso off-label di uno di tali medicinali al fine di ridurre la pressione concorrenziale che esso esercita sull’ altro, costituisce una restrizione della concorrenza «per oggetto».
La Corte precisa che le informazioni devono essere qualificate come ingannevoli (circostanza che spetta al giudice nazionale verificare) se mirano, da un lato, a indurre l’Ema e la Commissione in errore e, dall’altro, a enfatizzare, in un contesto di incertezza scientifica, la percezione da parte del pubblico dei rischi connessi all’uso off-label di Avastin.
Infine, la Corte ricorda che un’intesa non può beneficiare dell’esenzione prevista dall’articolo 101, paragrafo 3, TFUE se contiene restrizioni non indispensabili. Orbene, la diffusione d’informazioni ingannevoli relative ad un medicinale non può essere considerata «indispensabile».
Un’intesa volta a diffondere informazioni di tal tipo non può pertanto beneficiare di un’esenzione.
Notizie correlate: Caso Avastin/Lucentis: il Consiglio di Stato confermi la sanzione Antitrust





