
Le Aziende che producono medicinali sartani per il controllo della pressione arteriosa (noti anche come bloccanti del recettore dell’angiotensina II) sono tenuti a rivedere i loro processi produttivi in modo da non produrre impurezze della classe delle nitrosamine.
Alle Aziende sarà concesso un periodo di transizione per apportare tutte le modifiche necessarie, durante il quale si applicheranno limiti provvisori rigorosi per i livelli di queste impurezze.
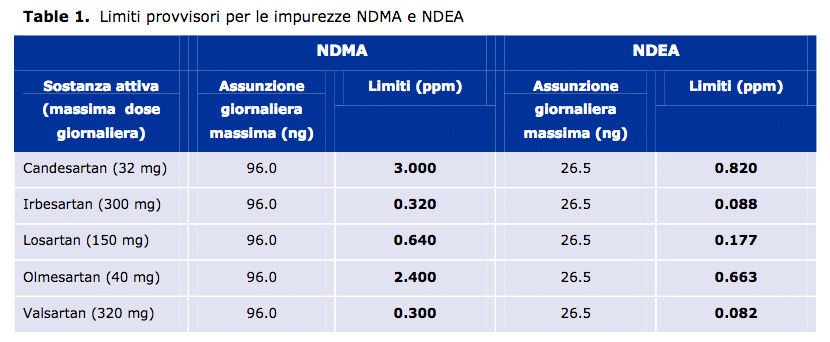 Dopo questo periodo, le Aziende dovranno dimostrare che i loro sartani non presentano livelli quantificabili di queste impurezze prima di poter essere utilizzati nell’UE.
Dopo questo periodo, le Aziende dovranno dimostrare che i loro sartani non presentano livelli quantificabili di queste impurezze prima di poter essere utilizzati nell’UE.
Queste raccomandazioni seguono la revisione EMA di N-nitrosodimetilammina (NDMA) e N nitrosodietilammina (NDEA), che sono classificate come probabili cancerogeni nell’uomo (sostanze che potrebbero causare il cancro) e sono state rilevate in alcuni sartani.
Per la stragrande maggioranza dei sartani, le impurezze non sono state trovate o erano presenti a livelli molto bassi.
La revisione ha stimato il più alto rischio di cancro possibile con queste impurezze.
Ha concluso che se 100.000 pazienti hanno assunto valsartan prodotto da Zhejiang Huahai (dove sono stati trovati i più alti livelli di impurezze) ogni giorno per 6 anni alla massima dose, potrebbero esserci 22 casi extra di cancro a causa dell’NDMA durante la vita di quei 100.000 pazienti.
L’NDEA in questi medicinali potrebbe portare a 8 casi extra in 100.000 pazienti che assumono il medicinale alla dose più alta ogni giorno per 4 anni.
Le stime sono state estrapolate da studi su animali e sono molto basse rispetto al rischio di sviluppare cancro nell’arco della vita nell’UE.
Nota: I 6 e 4 anni si riferiscono alla durata di tempo in cui NDMA e NDEA si è ritenuto siano stati presenti in valsartan prodotto da Zhejiang Huaha
In allegato la Comunicazione EMA
Notizie correlate: EMA. Un altro generico Valsartan prodotto in India inquinato. Ritirato dal mercato
Valsartan, Codacons inoltra la prima richiesta di risarcimento danni





