Assosalute ha pubblicato il rapporto 2023 sui numeri e gli indici dei farmaci da automedicazione. Il rapporto si
 struttura in 5 capitoli. Parte da una disamina a livello europeo del quadro sanitario ed economico, per poi restringere il focus al mercato farmaceutico italiano del 2022 e quindi al mercato dei prodotti che non necessitano di prescrizione. Il quarto capitolo si focalizza sui trend di spesa 2023-25 del mercato “non prescription” per poi analizzare le caratteristiche del mercato e degli attori del comparto.
struttura in 5 capitoli. Parte da una disamina a livello europeo del quadro sanitario ed economico, per poi restringere il focus al mercato farmaceutico italiano del 2022 e quindi al mercato dei prodotti che non necessitano di prescrizione. Il quarto capitolo si focalizza sui trend di spesa 2023-25 del mercato “non prescription” per poi analizzare le caratteristiche del mercato e degli attori del comparto.
Tralasciamo il mercato europeo e riportiamo il mercato italiano
Il mercato italiano
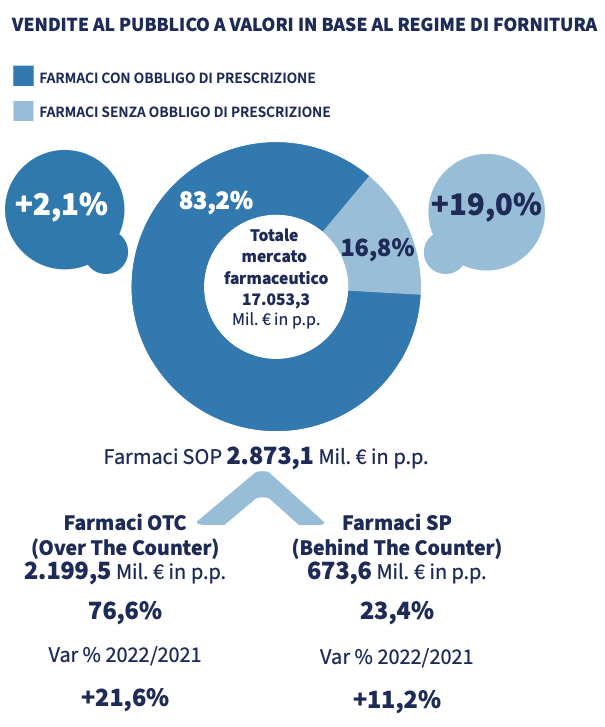
I dati di vendita relativi al 2022 mostrano una dispensazione di poco meno di 1,8 miliardi di confezioni di medicinali, per un controvalore superiore ai 17 miliardi di euro. I dati sono stati positivi sia per i farmaci con obbligo di prescrizione, sia per quelli senza ricetta. L’aumento della spesa è risultata superiore per i secondi (+19%) rispetto ai primi (+2,1%). «Per quanto riguarda le confezioni dispensate, i trend sono similari rispetto a quelli a valori: i farmaci con obbligo di prescrizione mostrano un andamento moderatamente positivo (+2,0%), mentre i medicinali senza obbligo di ricetta fanno osservare un deciso aumento, con un incremento a doppia cifra (+15,9%)» si legge nel rapporto.
Il 2022 ha rafforzato l’andamento positivo evidenziatosi già a partire da aprile 2021, complice l’allentamento delle misure restrittive imposte dal Covid-19, la ripresa circolazione di virus influenzali e simil influenzali. Più in generale dall’incidenza di disturbi non gravi. Per quanto riguarda il mercato, la farmacia detiene una quota di mercato stabile dell’89% a volumi e del 90,5% a valori dei medicinali senza obbligo di ricetta. L’e-commerce, per quanto in crescita, risulta ancora marginale con riguardo a questo comparto.
L’innovazione del mercato “non prescription”
Rispetto al mercato farmaceutico tradizionale, quello non prescription mostra margini di innovazione più contenuti, anche se le aziende del comparto investono costantemente al fine di innovare e rinnovare i farmaci già presenti sul mercato, di ottimizzarne i dosaggi e le forme di somministrazione e, quindi, l’efficacia, riducendone eventuali controindicazioni e interazioni. Ne consegue che sono frequentemente 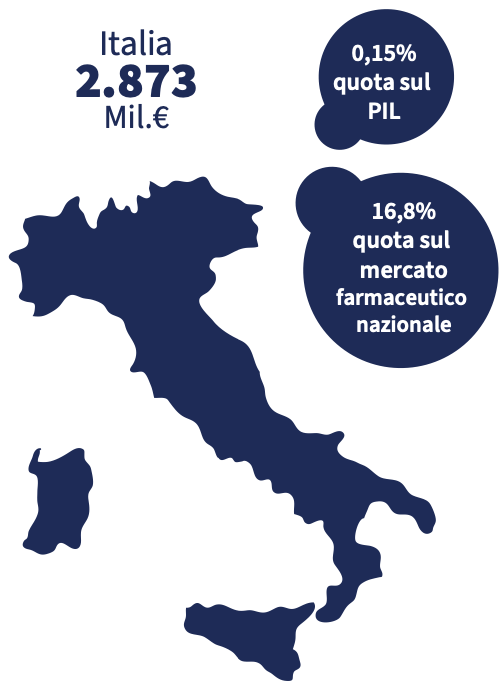 immessi sul mercato farmaci il cui principio attivo è in commercio da anni, ma con forme farmaceutiche o associazioni nuove. A livello di fatturato, il 54,1% è rappresentato da confezioni lanciate nel 2000 mentre quelle lanciate dal 2010 rappresentano il 36% delle vendite complessive.
immessi sul mercato farmaci il cui principio attivo è in commercio da anni, ma con forme farmaceutiche o associazioni nuove. A livello di fatturato, il 54,1% è rappresentato da confezioni lanciate nel 2000 mentre quelle lanciate dal 2010 rappresentano il 36% delle vendite complessive.
Le 5 categorie di prodotti più in uso
A livello di prodotti, le cinque categorie terapeutiche a maggiore incidenza di spesa e consumo (90,1% delle confezioni vendute e 87,2% della spesa) sono quelle dei medicinali per la cura delle malattie da raffreddamento, degli analgesici, dei farmaci gastrointestinali, dei dermatologici e dei medicinali per l’apparato circolatorio.
Trend 2023-2025
In considerazione delle condizioni date, è previsto un trend di crescita per l’anno in corso (+9,7%), andamento positivo che, seppure a tassi più contenuti, si manterrà anche negli anni a venire (+5% e +3,8% rispettivamente nel 2024 e 2025). A livello di ‘paniere’, in assenza di modifiche di carattere regolatorio, non sono attesi cambiamenti nella composizione della spesa. A livello geografico infine, i farmaci senza ricetta manterranno l’attuale configurazione: 50% al Nord, 21% al Centro e 27% al Sud.
Fonte Farmacia News del 10 luglio 2023
NUMERI E INDICI DELL’AUTOMEDICAZIONE – ED. 2023
Capitolo 1
Il quadro sanitario e farmaceutico in Europa nel 2022
 Capitolo 2
Capitolo 2
Il mercato farmaceutico in Italia nel 2022
Capitolo 3
Il mercato non prescription in Italia nel 2022
Infografica 1
Capitolo 4
Le previsioni sulla spesa e i consumi di farmaci senza obbligo di prescrizione: il triennio 2023-2025
Infografica 1
Capitolo 5
Struttura economica del settore farmaceutico non prescription e attori del mercato
Infografica 1 Infografica 2
Appendice
Inquadramento normativo
DOWNLOADS
Classificazione ai fini della vendita
La legge di riferimento, il Decreto Legislativo 24 aprile 2006 n. 219, comunemente denominato Codice del Farmaco, non contiene criteri in base ai quali un farmaco può ottenere lo status di “farmaco senza obbligo di prescrizione” (OTC e SOP).
Le linee guida emanate a livello europeo e la Circolare n. 13 del Ministero della Sanità del 16 ottobre 1997 (sui medicinali di automedicazione) permettono, tuttavia, di individuare i seguenti principi generali:
- contengono principi attivi (e relativi dosaggi) ben conosciuti, di largo e consolidato utilizzo, di comprovata efficacia e di cui siano ben noti i profili di sicurezza;
- sono destinati al trattamento di sintomi/disturbi semplici, riconoscibili per comune esperienza, non gravi e tendenzialmente risolvibili in breve tempo.
Il combinato disposto delle norme del Decreto Legislativo 219 ha portato a una duplice classificazione dei farmaci senza obbligo di ricetta”:
- Automedicazione o OTC quelli che possono fare comunicazione al pubblico (pubblicità) e sono liberamente accessibili nel punto vendita (self-service);
- SOP quelli che possono fare comunicazione al pubblico (pubblicità) ma non sono liberamente accessibili nel punto vendita (self-service)*.
L’Autorità responsabile dell’autorizzazione/registrazione di un farmaco senza obbligo di ricetta l’Agenzia Italiana del Farmaco (AIFA), che ne stabilisce anche la classificazione come farmaco di automedicazione/OTC o SOP.
 Con la Legge 16 novembre 2001 n. 405 è stato introdotto un “bollino di riconoscimento” da riportare obbligatoriamente sulle confezioni di tutti i farmaci senza obbligo di ricetta (automedicazione/OTC e SOP).
Con la Legge 16 novembre 2001 n. 405 è stato introdotto un “bollino di riconoscimento” da riportare obbligatoriamente sulle confezioni di tutti i farmaci senza obbligo di ricetta (automedicazione/OTC e SOP).
L’adozione del bollino è avvenuta, come previsto dalla Legge 405/2001, con Decreto del Ministero della Salute (1° febbraio 2002) che definisce, inoltre, le caratteristiche grafiche e le dimensioni del bollino da inserire, in modo visibile, sulle confezioni.
1 In quanto medicinali, anche quelli di automedicazione debbono sottostare a tutte le regole nazionali ed europee che regolamentano il settore farmaceutico: l’efficacia, la sicurezza di impiego per l’uso cui sono destinati, la qualità e gli standard produttivi.
2 Decreto Legislativo 24 aprile 2006 n. 219 di “Attuazione della direttiva 2001/83/ CE (e successive modifiche) relativa a un codice comunitario concernente i medicinali per uso umano, nonché della direttiva 2003/94/CE”.
3 Nel presente testo per i farmaci OTC si utilizza anche la sigla AM. I farmaci senza obbligo di prescrizione non di automedicazione sono indicati con la sigla SP mentre la notazione SOP è usata per indicare l’insieme di tutti i Farmaci Senza Obbligo di Prescrizione (cfr. Legenda).





