
L’AIFA rende disponibile il 17° Rapporto nazionale sulla Sperimentazione Clinica dei medicinali in Italia. L’edizione 2018 contiene i dati relativi a tutto il 2017.
Il Rapporto Nazionale sulla Sperimentazione Clinica dei medicinali costituisce un aggiornamento periodico sull’andamento qualitativo e quantitativo della ricerca clinica in Italia.
Occorre innanzitutto menzionare l’arricchimento del quadro normativo, grazie alla pubblicazione del nuovo Decreto Ministeriale 7 settembre 2017 sull’uso compassionevole, che ha affrontato in maniera proattiva le criticità rilevate negli ultimi anni in materia di accesso precoce e continuativo ai nuovi farmaci innovativi, anche in un’ottica di semplificazione delle procedure amministrative e possibilità di accesso a farmaciinnovativi per le malattie rare, mantenendo tuttavia le garanzie a tutela della sicurezza dei pazienti.
Dal Rapporto emerge che nel 2017 il numero totale delle sperimentazioni presentate in Italia è diminuito; nonostante ciò, la percentuale delle sperimentazioni condotte in Italia rispetto al resto d’Europa è rimasta sui livelli storici (18%).
Questo potrebbe essere dovuto in parte a una contrazione delle sperimentazioni globali o europee; il dato potrebbe riflettere, inoltre, i nuovi approcci nelle strategie di sviluppo dei farmaci, con l’uso sempre più diffuso di trial “complessi”, che racchiudono in una singola application due o anche più trial, che in passato sarebbero stati presentati come trial individuali, anche di fasi differenti.
Quest’ultima ipotesi è supportata dal fatto che l’unica fase di trial in aumento è quella tradizionalmente ricondotta sotto la definizione di fase I, che però è rappresentata prevalentemente da trial complessi difase I-II o I-III piuttosto che da trial tradizionali di fase I.
Circa la metà delle sperimentazioni condotte in Italia è in ambito oncologico ed emato-oncologico, confermando il dato degli anni precedenti; la diminuzione del numero totale di sperimentazioni osservata nel 2017 è distribuita in maniera abbastanza omogenea su tutte le altre aree terapeutiche.
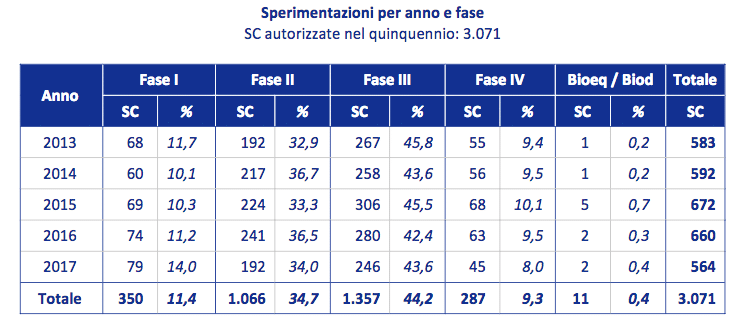 Continua, invece, il trend in rialzo dei trial in malattie rare, che rappresentano il 25.5% del totale (24.8% nel 2016), di cui l’80% sperimentazioni profit, con una distribuzione equilibrata fra le varie fasi di sperimentazione; occorre sottolineare che oltre il 31% delle sperimentazioni di fase I è su malattie rare. Le sperimentazioni no profit continuano ad aumentare in percentuale sul totale delle sperimentazioni condotte in Italia, arrivando nel 2017 a quota 26,4%, anche se questo incremento corrisponde a una diminuzione in numero assoluto di sperimentazioni, sebbene più contenuta rispetto alle sperimentazioniprofit.
Continua, invece, il trend in rialzo dei trial in malattie rare, che rappresentano il 25.5% del totale (24.8% nel 2016), di cui l’80% sperimentazioni profit, con una distribuzione equilibrata fra le varie fasi di sperimentazione; occorre sottolineare che oltre il 31% delle sperimentazioni di fase I è su malattie rare. Le sperimentazioni no profit continuano ad aumentare in percentuale sul totale delle sperimentazioni condotte in Italia, arrivando nel 2017 a quota 26,4%, anche se questo incremento corrisponde a una diminuzione in numero assoluto di sperimentazioni, sebbene più contenuta rispetto alle sperimentazioniprofit.
Nel Rapporto anche quest’anno sono presentati i dati relativi alla partecipazione dell’Italia al progetto Voluntary Harmonization Procedure (VHP) per la valutazione congiunta dei protocolli clinici che si svolgono in più Stati dell’Unione Europea.
Anche per queste si è osservata nel 2017 una flessione nel numero totale condotto in Europa (circa -10%), a cui ha corrisposto una lieve flessione nel numero assoluto di richieste di partecipazioni dell’Italia alle VHP (-5%).
Per quanto riguarda le sperimentazioni multinazionali sembra che la riduzione globale abbia coinvolto l’Italia in percentuale minore rispetto al resto d’Europa; il nostro Paese si è confermato, infatti, tra i primissimi Reference Member States (dopo Regno Unito e Repubblica Ceca).
Nel Rapporto sono presentati anche i dati relativi alle domande di partecipazione al Bando AIFA per la Ricerca Indipendente 2017, che ha visto un cospicuo aumento del numero di domande rispetto al 2016, 428 rispetto alle 343 del 2016.
La numerosità maggiore di studi presentati è stata riscontrata nell’area sullemalattie rare e in quella sulle popolazioni fragili e con polimorbidità; oltre la metà delle domande è relativa a studi interventistici, equamente distribuiti soprattutto fra le fasi II, III e IV; oltre un terzo sono studi osservazionali e meno del 10% sono revisioni o metanalisi.
La sezione relativa alla Ricerca Indipendentesarà aggiornata nel corso del 2017 in seguito alla conclusione della valutazione dei protocolli e definizione della relativa graduatoria.
Notizie correlate: Gli effetti collaterali di un farmaco si scoprono quando è già in commercio?





