Le dichiarazioni del presidente Enrique Häusermann nell’audizione odierna sulla Legge  annuale per la Concorrenza 2021 in Commissione Industria al Senato
annuale per la Concorrenza 2021 in Commissione Industria al Senato
«L’abrogazione del patent linkage non avrà alcun effetto negativo sui brevetti farmaceutici e non determinerà alcuna crescita del contenzioso. La scelta del Governo di abrogare un istituto anticoncorrenziale che esiste solo nel nostro Paese corregge una grave stortura rispetto ai principi espressi dalla normativa Europea in tema di concorrenza e normativa farmaceutica».
Ad affermarlo è stato Enrique Häusermann, presidente di EGUALIA, organo ufficiale di rappresentanza dell’industria dei farmaci generici equivalenti, biosimilari e value added medicines in Italia, ascoltato oggi in audizione dalla Commissione Industria del Senato, nell’ambito dell’esame della Legge annuale per il mercato e la concorrenza 2021 (A.S. 2469).
Il testo proposto dal Governo prevede l’abrogazione dell’art. 11 della legge Balduzzi (L.189/ 2012) che ha introdotto la non classificabilità di farmaci equivalenti come farmaci a carico del SSN (dunque inseriti nella c.d. liste di trasparenza) prima della data di scadenza del brevetto o del certificato di protezione complementare, pubblicata dal Ministero dello sviluppo economico.
Sull’incongruenza della norma rispetto al diritto europeo in materia di concorrenza si è più volte espressa anche l’Antitrust a partire dal 2012 e da ultimo nel 2021, giudicandola “suscettibile di favorire condotte ostruzionistiche su base brevettuale da parte delle imprese titolari dei farmaci “originatori”, che potrebbero fare ricorso ad azioni giudiziali al solo fine di ritardare l’entrata dei genericisti sul mercato”( ).
 «Questa norma – ha ribadito Häusermann – oltre a favorire condotte ostruzionistiche da parte delle società titolari di brevetto, ha effetti potenzialmente lesivi per la salute pubblica determinando un incremento di spesa per il SSN quotato finora in oltre 220 milioni di euro. La sua rimozione consentirebbe alle imprese di espletare tutte le procedure negoziali per la conseguente classificazione tra i farmaci rimborsati dal SSN senza ledere in alcun modo la tutela brevettuale garantita dalle norme comunitarie e nazionali».
«Questa norma – ha ribadito Häusermann – oltre a favorire condotte ostruzionistiche da parte delle società titolari di brevetto, ha effetti potenzialmente lesivi per la salute pubblica determinando un incremento di spesa per il SSN quotato finora in oltre 220 milioni di euro. La sua rimozione consentirebbe alle imprese di espletare tutte le procedure negoziali per la conseguente classificazione tra i farmaci rimborsati dal SSN senza ledere in alcun modo la tutela brevettuale garantita dalle norme comunitarie e nazionali».
«Va detto con assoluta e definitiva chiarezza – ha proseguito il presidente di EGUALIA – che l’abolizione del patent linkage non lede in alcun modo la garanzia della tutela brevettuale e soprattutto non comporta il venire meno della responsabilità giuridica dell’azienda responsabile dell’immissione sul mercato del farmaco equivalente, che sarà l’unica a rispondere di eventuali violazioni. E merita di essere sottolineato che a oggi tutte le cause di patent linkage che sono state portate davanti a un giudice, si sono concluse con l’annullamento di privative industriali non solidamente sostenute dai requisiti legali. Insomma – ha concluso Häusermann – l’abrogazione di questa norma non determinerà in alcun modo l’ingresso di una valanga di nuovi generici prima della scadenza brevettuale. Eviterà solo lo stop alle normali procedure di rimborsabilità lasciando la materia brevettale ai soggetti individuati dalla legge».
Notizia Egualia . 22 febbraio 2022
Il parere di Scaccabarozzi (Farmindustria): “L’abolizione del Patent Linkage è inutile”
La posizione di Farmindustria sui farmaci equivalenti “è sempre stata molto chiara: non un giorno prima, non un giorno dopo la scadenza brevettuale. E tutto ciò il sistema attuale già lo consente: se prima della legge Balduzzi non era possibile per i genericisti muoversi prima della scadenza brevettuale, quella legge lo ha consentito e normato, permettendo di registrare, negoziare, prezzare, produrre e stoccare il proprio farmaco in anticipo per essere pronti al giorno zero. Per questo l’articolo 15 del Ddl Concorrenza, che cancella l’articolo 11 della legge Balduzzi (il cosiddetto ‘patent linkage) è del tutto inutile”.
Nota: Patent Linkage (ndr: collegamento brevettuale) significa collegare l’approvazione alla commercializzazione da parte dell’autorità regolatoria del farmaco allo stato di brevetto del farmaco originator.
Quando l’autorità competente (di solito un’agenzia regolatoria del farmaco) è posta di fronte a una domanda di AIC o di accesso alla rimborsabilità da parte di un produttore di equivalenti deve procedere a un controllo della copertura brevettuale del farmaco originatore, e, nel caso in cui questa ancora sussista in qualche modo (es. per l’esistenza di certificati protettivi complementari, di cui al regolamento 469/2009/EC o coperture per cosi dire collaterali, come nel caso di estensioni di esclusiva commerciale per determinati usi terapeutici) neghi fino alla sua effettiva scadenza la procedibilità dell’equivalente.
Con il patent linkage si possono mettere in atto pratiche volte a ritardare l’ingresso dei farmaci equivalenti sul mercato anche fino a 6/8 mesi. L’abrogazione del patent linkage consente ai produttori di equivalenti di espletare tutte le procedure negoziale per il prezzo e rimborso per essere pronti ad entrare in commercio appena scaduto il brevetto.
Si può parlare di libera concorrenza nel mercato farmaceutico?
Concorrenza è intesa come libertà di iniziativa economica (art. 41 della Costituzione), e quindi come diritto di agire nel mercato liberamente e intraprendere qualsivoglia attività imprenditoriale (in senso soggettivo); e come situazione di mercato, e quindi come diritto di libero accesso al mercato (in senso oggettivo). Tale diritto è garantito, tra l’altro, dalla legislazione antimonopolistica. La libera concorrenza provoca una concorrenza sul prezzo controllandolo e abbassandolo per rendere più competitivo il proprio prodotto a beneficio dei consumatori.
La politica della concorrenza costituisce un elemento essenziale dell’integrazione comunitaria, in quanto deve consentire alle imprese di competere a parità di condizioni sui mercati di tutti gli Stati membri, assicurare la concorrenzialità dei loro prodotti e servizi sul piano mondiale, e al contempo tutelare nel modo migliore i consumatori europei.
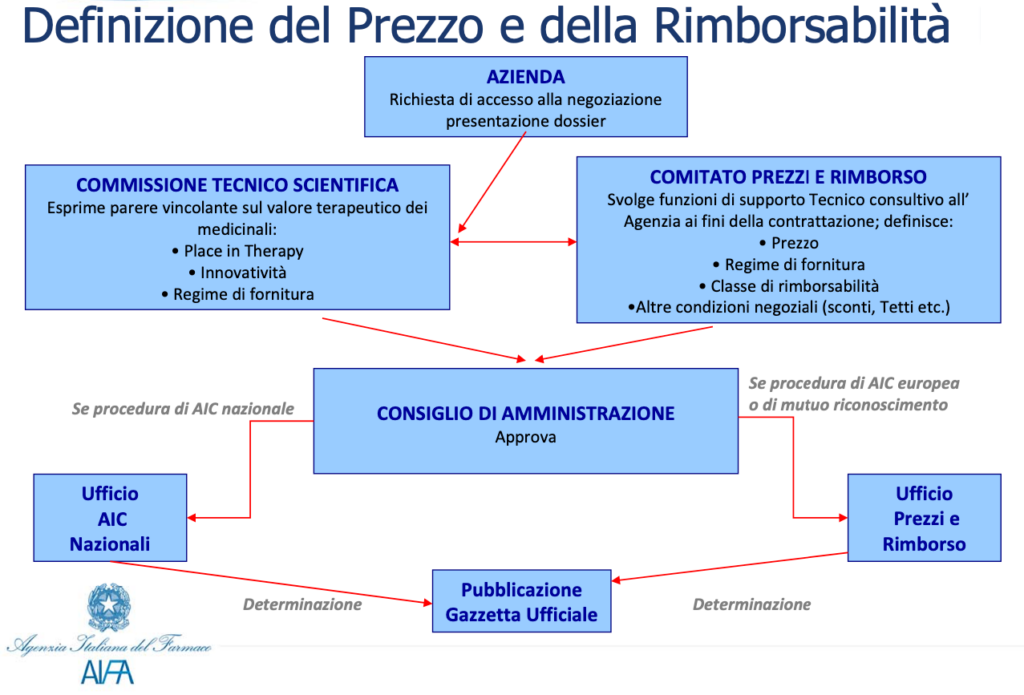 Per il “mercato” farmaceutico si può parlare di concorrenza imperfetta. Espressione che fa riferimento a tutte quelle forme di mercato, non perfettamente concorrenziali, in cui non sono soddisfatte una o più condizioni che caratterizzano i mercati in concorrenza perfetta.
Per il “mercato” farmaceutico si può parlare di concorrenza imperfetta. Espressione che fa riferimento a tutte quelle forme di mercato, non perfettamente concorrenziali, in cui non sono soddisfatte una o più condizioni che caratterizzano i mercati in concorrenza perfetta.
Nel mercato farmaceutico da un lato può esserci un monopolista, finché c’è un brevetto che però non può imporre un prezzo, nemmeno alla scadenza del brevetto in un regime di libera concorrenza, dall’altro c’è un solo acquirente (monopsonio) che con i suoi comportamenti influenza la formazione dei prezzi.
Il monopsonista fissa il prezzo in modo da massimizzare la propria funzione di profitto, dando vita a una materializzazione di prezzi diversa da quella che si verificherebbe in condizioni di concorrenza perfetta.
Nella fattispecie l’AIFA interviene nel governo della spesa farmaceutica attraverso le procedure di negoziazione del prezzo dei farmaci e di gestione del Prontuario Farmaceutico Nazionale (PFN).
In Italia, si verifica in molti casi che il prezzo negoziato, di fatto imposto, sia molto più basso rispetto agli altri Paesi europei. Ciò provoca una esportazione dei farmaci italiani a basso prezzo verso quei Paesi il cui prezzo è più alto, speculando sul differenziale, nel pieno rispetto delle norme europee sulla concorrenza.
Con l’introduzione dei generici, poi classificati equivalenti, alla scadenza del brevetto, la concorrenza avrebbe potuto dare i suoi effetti. La riduzione dei prezzi è la conseguenza del meccanismo di rimborso che induce le aziende a ridurre i prezzi dei propri prodotti per allinearli al prezzo rimborsato dal SSN ovvero a un livello ancora più basso per farli diventare prodotti di riferimento, costringendo i concorrenti a ulteriori ribassi. Un meccanismo di concorrenza che appare efficace, anche se non si può parlare di concorrenza perfetta.
Tutto bene quindi? Purtroppo non è così.
Il comma 130 dell’art. 3, l. 28 dicembre 1995, n. 549, dispone che un farmaco generico può ottenere la medesima classificazione dell’originator purché offra un prezzo almeno del 20% inferiore a quello del farmaco originatore.
In seguito il decreto Balduzzi per i farmaci generici ha escluso la contrattazione del prezzo nel caso in cui l’Azienda produttrice indichi un prezzo “di evidente convenienza”, secondo i parametri indicati dal decreto del Ministero della salute solo per l’ipotesi in cui l’Azienda produttrice indichi un prezzo “conveniente”. Si fa invece ricorso alla contrattazione se il prezzo proposto per il generico è superiore alle percentuali introdotte dal cosiddetto decreto scaglioni.
Resta comunque fermo il limite di un prezzo che sia almeno del 20% inferiore a quello del farmaco originatore, previsto dalla norma speciale sui generici, introdotta dal comma 130 dell’art. 3, l. n. 549 del 1995 e ribadito nella sentenza del Consiglio di Stato, sez. III, n. 6716 del 27 novembre 2018 secondo cui per la classificazione come equivalenti agli “originatori” occorre uno sconto di prezzo di almeno il 20%.
Con buona pace della concorrenza.
Notizie correlate: AIFA. Valutazioni economiche: il valore di un medicinale è dato dall’utilità marginale che il paziente, il SSN e/o la società possono ottenere dalla sua acquisizione.