
L’AIFA rende disponibile il 16° Rapporto nazionale sulla Sperimentazione Clinica dei medicinali in Italia. L’edizione 2017 contiene i dati relativi a tutto il 2016.
Il Rapporto Nazionale sulla Sperimentazione Clinica offre una lettura retrospettiva dell’andamento della ricerca sui farmaci in Italia e restituisce un’interessante fotografia di come lo sviluppo del settore evolva nel nostro Paese, offrendo spunti utili per conoscere le aree terapeutiche maggiormente indagate, quelle su cui potenziare gli investimenti e soprattutto i ritorni in termini di salute per i pazienti.
Il primo dato positivo da sottolineare è l’aumento del numero delle sperimentazioni in Italia sul totale europeo, che dal 17% del 2015 passa al 20% del 2016. Un incremento di tre punti percentuali che si registra per la prima volta in cinque anni e su cui ci sentiamo incoraggiati a lavorare per rendere tale trend una costante. In termini assoluti si conferma, quindi, la tenuta delle sperimentazioni 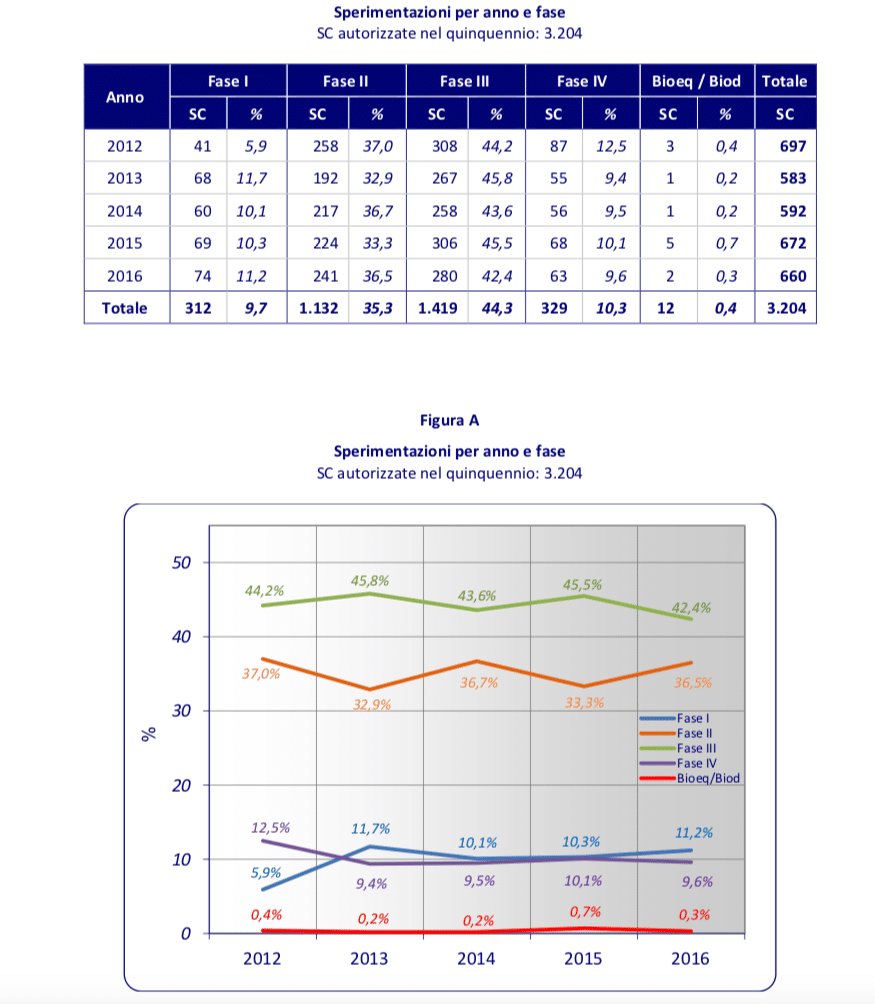 presentate e autorizzate a livello nazionale, con un aumento del 3% rispetto all’anno precedente, se si considera anche il numero delle sperimentazioni ancora in valutazione alla data del 31 dicembre 2016.
presentate e autorizzate a livello nazionale, con un aumento del 3% rispetto all’anno precedente, se si considera anche il numero delle sperimentazioni ancora in valutazione alla data del 31 dicembre 2016.
E’ l’analisi della tipologia dei trials condotti che ritrae come l’R&D nel campo farmaceutico stia progressivamente cambiando nel nostro Paese, a favore di un incremento di quelli a disegno complesso (seamless, adattativi, ecc.) che abbracciano più fasi o sono collocati per definizione nelle fasi precoci della sperimentazione, anche se di fatto sono disegnati spesso come veri e propri pivotal trials.
Nel settore delle malattie rare, invece, dove si rileva una positiva tendenza all’incremento rispetto al 2015 con una forte prevalenza di sperimentazioni profit, si riscontra una distribuzione pressoché identica fra le fasi precoci e la fase III, segnale di spostamento continuo verso un potenziale sviluppo concreto di farmaci per condizioni orfane.
Come sempre, in Italia oltre il 97% delle sperimentazioni è condotta su pazienti, sono rarissime quelle in cui vengono arruolati volontari sani. La riflessione da fare, tuttavia, è in merito alle popolazioni oggetto dei trials: le donne, i bambini e gli anziani restano ancora campioni scarsamente indagati in modo specifico dalla ricerca clinica. Se, da un lato, non è purtroppo disponibile per il 90% delle sperimentazioni risalire alla composizione di genere dei pazienti arruolati, è comunque indicativo il dato davvero minimo della quota di sperimentazioni esclusivamente nel genere femminile (5,5%), così come quello nelle popolazioni pediatrica (8,6%) e anziana (1%). Proprio per questo motivo, l’AIFA ha inteso dare impulso ai bandi di ricerca indipendente promossi attingendo al fondo del 5% delle spese promozionali sostenute dalle Aziende farmaceutiche, che già dal 2016 prevedono focus dedicati per incentivare protocolli di studio finalizzati a verificare gli effetti dei farmaci per queste categorie. Vogliamo inoltre pensare che il lieve incremento delle sperimentazioni no profit registrato lo scorso anno derivi anche dalla riattivazione dei bandi AIFA, che confidiamo abbia contribuito a dare nuovamente fiducia al settore.
Continua la ricerca clinica nazionale nell’ambito dei farmaci oncologici e immunomodulatori, che insieme costituiscono la metà delle sperimentazioni cliniche nel nostro Paese. Si assiste ad un lieve aumento delle sperimentazioni nell’area neurologica, ematologica e immunitaria, mentre deve destare attenzione il calo di quelle in ambito infettivologico, che rappresenta invece il secondo settore per spesa farmaceutica in Italia dopo l’oncologia. Nell’attuale emergenza globale relativa alla progressiva resistenza agli antimicrobici, questo è senz’altro un aspetto su cui concentrare e rivedere le strategie, per favorire maggiori investimenti per lo studio di nuove molecole in grado di sconfiggere i cosiddetti “super-batteri” e difendere strenuamente l’insostituibile risorsa degli antibiotici, e non trovarsi in un prossimo futuro sprovvisti di terapie anche per le infezioni oggi più comuni.
Un futuro già presente è invece quello delle nuove terapie geniche, come confermano i dati sui trials condotti nel 2016 in quest’area: le sperimentazioni che vedono valutazioni di farmacogenetica sono oltre il 15% del totale e continua lo spostamento verso sperimentazioni su farmaci biologici/biotecnologici.
Anche quest’anno presentiamo i dati relativi alla partecipazione dell’Italia al progetto Voluntary Harmonization Procedure, per la valutazione congiunta dei protocolli clinici che si svolgono in più Stati dell’UE. Delle sperimentazioni presentate su base nazionale, 122 avevano avuto la valutazione coordinata mediante VHP nel corso del 2016. Il numero delle partecipazioni dell’Italia a queste procedure coordinate a livello europeo è rimasto elevato, vicino al 100% delle domande di partecipazione presentate, con un incremento delle procedure gestite come Stato membro di riferimento, che ci porta come agenzia nazionale al secondo posto in UE dopo il Regno Unito, per un totale di 27 procedure gestite dall’Italia come Rapporteur.
Lo scenario è quindi motivante per continuare a lavorare con impegno assiduo e quotidiano affinché sempre più terapie possano raggiungere il paziente in modo appropriato, grazie a processi di sviluppo spediti e puntuali. Molto ci aspettiamo anche dalle nuove disposizioni di legge che porteranno maggiore semplificazione e razionalizzazione nel settore e che formalizzeranno l’obiettivo di una ricerca clinica più specifica e tarata sulle diverse popolazioni (di genere e pediatrica in particolare), per offrire risposte cliniche altrettanto precise ed efficaci.
Notizie correlate: Adeguamento alle tariffe per le richieste di autorizzazione di sperimentazioni cliniche e di emendamenti sostanziali (27/04/2018)





